前言
自1986年第一个治疗性抗体进入临床后,越来越多的治疗性抗体得到迅速发展,抗体药也成为现代生物医学重要的组成部分。大多数抗体药物的给药方式为静脉注射,少数为皮下注射或肌肉注射。其给药方式的限制,桎梏了较多靶点的临床广泛应用。而1989年从骆驼科中发现的纳米抗体,不仅刷新了人类对抗体的认识,更给抗体药的给药方式带来了革新,发现更多的给药方式可通过其实现。小编今天为大家介绍纳米抗体药物在吸入式给药、皮下注射给药、口服递送以及跨血脑屏障递送中的应用研究。
全长IgG给药的局限性
VHH结构特点及给药优势
纳米抗体是在骆驼科及鲨鱼科动物血清中大量存在的天然重链抗体(HcAb)的可变结构域(VHH/IgNAR),是目前已知的可结合目标抗原的最小单位。

相较于常规抗体,纳米抗体的理化性能优势有:1.体积与分子量小,具有很好的渗透性;2.更高的稳定性,能适应多种不同的给药方式;3.免疫原性低,与人源抗体可变区VH结构非常相似,同源性高达90%;4.特殊的CDR3结构带来的更有利的抗原表位识别;5.能够实现快速地大规模生产,且生产成本低。
纳米抗体皮下注射给药
皮下注射是指将药液注射到皮肤与肌肉之间的疏松组织中,注射部位一般选择在皮薄而容易移动,但活动较小的部位,常用注射部位为上臂及股外侧。皮下注射的吸收速率通常均匀而缓慢,因而作用持久。然而传统抗体药分子量较大,本身免疫原性就很高,皮下注射又是相对更容易引起抗药抗体的一种途径,因此传统抗体开发成皮下注射的瓶颈大,而纳米抗体在这方面拥有显著优势。
2021年11月25日,国家药品监督管理局(NMPA)批准了皮下注射PD-L1抗体恩沃利单抗(KN035)用于标准治疗失败的MSI-H/dMMR晚期结直肠癌、胃癌及其它实体瘤。它是由康宁杰瑞自主研发并与思路迪(北京)医药科技有限公司共同开发的。此次获批标志着恩沃利单抗成为全球首个皮下注射 PD-L1 抗体药物、中国首个且唯一获批 MSI-H/dMMR 泛瘤种适应症的免疫治疗药物、首个上市的国产PD-L1 抗体药物。
KN035是一种由VHH与Fc段组成的单特异性抗体,分子量是完整抗体分子量的一半,它可结合人PD-L1蛋白,并阻断其与受体PD-1的相互作用,解除肿瘤通过PD-1/PD-L1途径对T细胞的抑制作用,调动免疫系统的抗肿瘤活性杀伤肿瘤。与大多数同靶点药物的给药方式不同,它采用的是皮下注射,只需30秒即可完成给药,大大提高其便捷程度,节约医患时间及医疗资源。
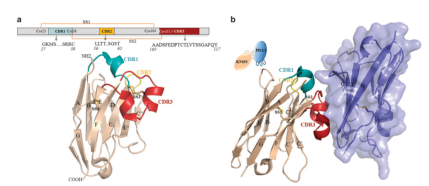
图2KN035/PD-L1整体结构[3](a为KN035序列和结构,b为KN035/PD-L1结合结构
纳米抗体吸入式给药
吸入式给药是指一些气体及挥发性药物经过呼吸道直接进入肺泡,由肺泡表面吸收,产生全身作用的给药方式。由于肺泡表面积大,又与血液只隔肺泡上皮及毛细血管内皮各一层,且毛细血管内血流量又大,故吸收迅速。气体或挥发性药物吸入后,由肺上皮和呼吸道黏膜吸收,对肺部疾病可使药物直接作用于病变部位。传统抗体的吸入式递送存在挑战性,并且其抗体需要具有制备和递送所需的有利物理化学性质。
1.治疗新冠感染的作用机制及案例
自2019年12月开始,一种新型、高传染性的严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2,COVID-19)在全球范围内爆发,已造成数亿人感染。与其他人畜共患冠状病毒(SARS-CoV-1、MERS)一样,新型冠状病毒表达一种表面Spike (S)糖蛋白,该蛋白由两个亚基S1和S2组成,形成同源三聚体S蛋白。这种同源三聚体S蛋白可以与宿主细胞相互作用。新型冠状病毒与宿主细胞之间的相互作用是由S1亚基的受体结合结构域(RBD)介导的,该结构域与血管紧张素转换酶2(ACE 2)的肽酶结构域(PD)结合。之后,S2亚基发生了剧烈的构象变化,并引发了膜融合。新型冠状病毒S蛋白与ACE2(Kd为15 nM)的结合亲和力是SARS-CoV-1 S蛋白的10-20倍,推测这可能是SARS-CoV- 2更具传染性的原因[3]。
尽管传统单克隆抗体的治疗能够减缓病者的病情,但其高剂量的使用也反映出静脉给药效率低,同时传统的单克隆抗体不能快速、低成本地生产,也不能快速开发针对突变病毒株的抗体药物,不易优化。而具有优良理化性能的纳米抗体则能很好的解决这些问题。它们可以雾化,吸入给药,并直接应用于感染部位,肺部药物浓度高,高生物利用度,只需少量药物就能达到效果,既降低用药成本,也降低副作用发生风险。因此,在治疗呼吸道病毒方面具有非常潜力。
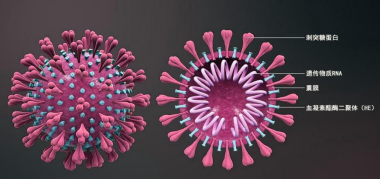
图3 新冠病毒结构 https://cn.bing.com/images
2020年 UCSF Michael Schoof团队报道了AeroNabs分子气雾剂,基于合成文库中筛选出的纳米抗体分子,可与鼻喷雾剂或吸入器一起用于个人预防2019冠状病毒病(COVID-19)。该纳米体能够破坏SARS-CoV-2棘突与宿主细胞受体的相互作用。
来自匹兹堡大学的项宇飞和合作者用重组SARS-CoV-2 RBD免疫骆驼,使用蛋白质组学方法和质谱分析,鉴定了大量高效的SARS-CoV-2中和纳米抗体。研究发现,几种纳米抗体在极低的剂量下中和了SARS-CoV-2,半抑制浓度低于pmol。他们构建了多价VHHs,并实现了超高的中和效率(半抑制浓度低至0.058 ng/ml),并可能防止突变病毒株逃逸。这些热稳定的VHHs可以由微生物快速大量生产,并且能够抵抗冷冻、干燥和雾化。他们进一步将最有效的三价 Tri-Nb21开发成PiN-21气溶胶,可以有效预防和治疗感染SARS-CoV-2的叙利亚仓鼠,大大降低病毒载量,预防肺损伤和病毒性肺炎[3]。
2.洛启生物——IL4R
哮喘是世界公认的医学难题,被世界卫生组织列为疾病中四大顽症之一,也成为仅次于癌症的世界第二大致死和致残疾病。哮喘的用药包括静脉、皮下、口服和吸入等方式,其中吸入给药是最佳的给药方式,能直达肺部病灶区,避免肝脏的首过效应,减少系统性暴露毒性,规避皮下给药的副作用。
2021年11月26日,洛启生物宣布申报雾化液LQ036,一种靶向IL-4R的纳米抗体创新药。这是由洛启生物自主研发的针对中重度哮喘治疗的核心药物,也是全球首款重度哮喘治疗吸入式纳米抗体药物。洛启生物的LQ036相比于阿斯利康的IL-4R吸入式骨架蛋白产品PRS-060,给药频率更低,活性更高。该药有望为全球哮喘患者提供新的治疗方案。
纳米抗体口服递送
对于慢性疾病,用药的便利性是一个重要的评价因素和竞争点,口服给药不仅提高用药的便利性,还能减少系统性的免疫抑制带来的诸多毒副作用,前景可期。但是口服蛋白质或者肽类药物,需要克服胃酸、胃/胰蛋白酶、黏液屏障和上皮屏障重重困难,截止目前仅有少数的蛋白质/多肽类药物获批。
1.口服递送药物V565
VHsquared公司从TNF-α免疫羊驼的纳米抗体噬菌体文库中,筛选获得对胃肠道蛋白酶具有天然耐受性的TNF-α中和纳米抗体,对其做进一步的结构改造以增强其抗蛋白酶水解的能力,最终得到分子V565。VHsquared公司对V565的剂型做了针对性的设计,将其制成口服的肠溶小片,开发用于局部治疗炎症性肠病(IBD)患者。
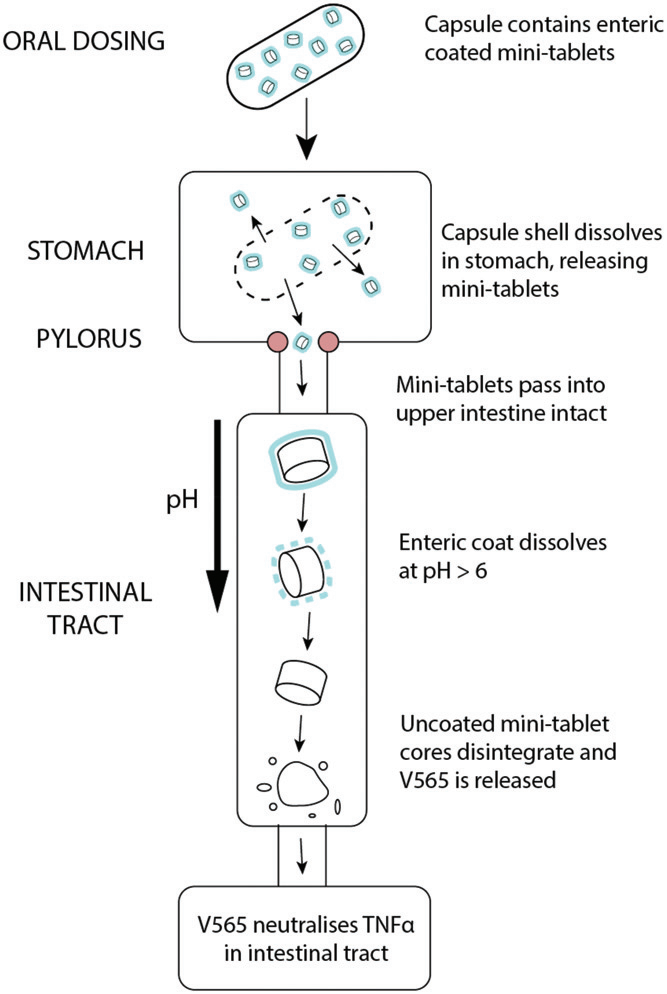
图4 肠溶小片V565口服后在胃肠道中的溶解示意图。
口服用药时,胶囊壳在胃里很容易溶解,释放出肠衣型V565微小药片。这些药片在低pH值下能抵抗溶解,并完整地通过幽门。当V565微小药片通过肠道时,pH值增加,引发肠溶包衣的溶解,使活性V565被释放出来。在IBD患者中,V565将进入肠道上皮损伤部位的发炎固有层,而过量的V565不会与肠道上皮结合,将通过淋巴被清除并进入血液循环。https://doi.org/10.1080/03639045.2018.1542708.
体外蛋白酶耐受性检测实验结果表明,V565对多种胃肠道溶液和金属蛋白酶具有抵抗能力。V565的I期临床试验数据显示[4],V565分子在克罗恩病患者的组织中有明显的高浓度分布。同时,口服7天后,活体组织切片中信号通路蛋白的磷酸化水平降低约50%,显示了药物对TNFα相关的信号通路的抑制作用。
目前,V565正在进行II期临床试验(NCT02976129)。抗体口服给药的尝试非常有意义,V565会有怎样的进展让我们拭目以待。
2.口服递送抗ETEC的纳米抗体
致病性肠毒素大肠杆菌(Enterotoxigenic Escherichia coli ,ETEC) 是一种非侵入性病原体。ETEC可通过其表面的定植因子 (CF) 介导小肠粘附,一旦与小肠结合,细菌就会产生毒素,导致水样腹泻,据估计,ETEC在全球零星或流行性爆发期间每年会导致大约 380,000 人死亡。由于ETEC菌株的巨大异质性,开发有效地覆盖多种遗传变异的 ETEC 菌株的疫苗非常具有挑战性,目前为止还没有获批的ETEC预防型疫苗。
马萨诸塞大学医学院Wangyang团队[5]通过免疫美洲驼,经筛选获得识别ETEC细菌表面的定植因子粘连素亚基 (CfaE) 的VHHs,体外实验中这些VHHs显示出针对 11 种主要致病性 ETEC 菌株的交叉结合效力。
为了获得最佳功能并提高VHHs在粘膜中的稳定性,研究者将VHH设计成IgAFc融合抗体(VHH-IgA)给小鼠口服(图5),发现VHH-IgA可以有效地降低小鼠肠道中的致病菌数量,并且效果优于商业化的抗菌药物Travelan®(图6)。Wang yang团队研发的可口服递送的抗CfaE纳米抗体对进一步合理设计泛ETEC疫苗有实践参考价值。

图5 图示VHH给药的预处理方案。
在灌胃10E7CFU的H10407之前一或两小时进行VHH-IgA灌胃给药。

图6 2R215-mIhA2和1D7-mIgA2对致病菌的抑制效力优于Travelan。
纳米抗体跨血脑屏障递送
血脑屏障(BBB)是指脑毛细血管壁与神经胶质细胞形成的血浆与脑细胞之间的屏障和由脉络丛形成的血浆和脑脊液之间的屏障,这些屏障能够阻止某些物质由血液进入脑组织,同时也阻止了大多数小分子药物和大分子(例如肽,蛋白质和基于基因的药物)的转移。
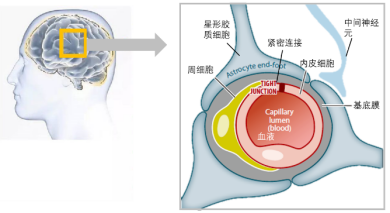
图7 血脑屏障(BBB)结构。https://cn.bing.com/images
血脑屏障是一把双刃剑,虽能阻止有害物质进入我们的脑组织,却也阻挡了治疗药物的进入。它允许关键化合物通过几种途径从血液中选择性地进入大脑,如营养物质、信号分子和激素,包括被动融合、受体介导的胞吞(RMT)、吸附介导的胞吞(AMT)和载体介导的转运(CMT)。
目前针对神经中枢系统疾病治疗的方法,如直接注射或破坏血脑屏障使其产生“漏洞”,具有感染、组织损伤和神经毒性等风险,因此跨血脑屏障递送药物对相关疾病的治疗具有重大意义。

图8 大脑中受体介导的胞吞作用(RMT)和吸附介导的胞吞作用(AMT)过程的示意图[6]
中枢神经系统疾病的治疗药物必须克服血脑屏障,并在大脑中达到有效的浓度。一种很有前途的策略是通过胞吞作用(RMT)系统进行运输,该系统使用靶向转铁蛋白受体(TfR)或胰岛素受体(IR)的抗体作为载体,协助药物穿过血脑屏障。对于这些策略,VHH显示出独特的优势,具有穿透血脑屏障后穿透脑实质的显著能力。研究表明,与传统的单克隆抗体相比,VHH具有更小的体积,可以到达更深的脑组织,并具有更广泛的脑暴露,而且具有更高的稳定性。目前,研究人员已经开发了多个VHHs(表1,图9),用于作为通过血脑屏障治疗中枢神经系统疾病的载体或作为神经成像工具。同时在朊病毒治疗与阿尔兹海默症治疗上有明显成效。

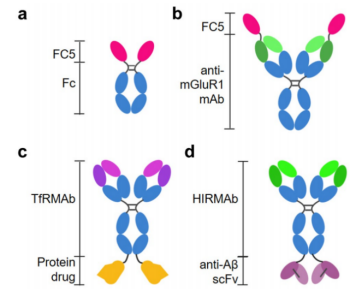
图9 融合蛋白的结构和特征。a:FC5与人Fc融合的分子结构。b:融合蛋白:FC5作为携带药理蛋白mGluR1的载体。c :TfRMAb结构域是血脑屏障传递的载体。d :HIRMAb与治疗性蛋白抗AβscFv融合,用于治疗阿尔茨海默病[6]
1.纳米抗体用于朊病毒治疗的研究
朊病毒疾病,也被称为传染性海绵状脑病(TSEs),参与了细胞朊病毒蛋白(PrPC)错误折叠成与疾病相关的亚型痒病朊蛋白(PrPSC)。蛋白质的沉积和聚集表现出神经毒性,并导致脑实质的海绵状变化。研究人员[2]从免疫骆驼构建的噬菌体展示文库中筛选出VHH PrioV3。经过深入的研究表明,VHH PrioV3与PrPC和PrPSC的线性表位都有很高的结合能力。此外,整合细胞的免疫荧标记显示,PrioV3具有穿透细胞膜并与细胞质PrPC结合的能力。它还能在体外穿过大鼠和人脑微血管内皮细胞形成的人工血脑屏障,并在大鼠静脉注射后在脑实质中有效融合,证明了体内穿过血脑屏障的特性。到达靶点后,PrioV3能完全展现出其药理作用并且能广泛消除PrPSC在朊病毒神经元细胞中的复制。
2.纳米抗体用于阿尔兹海默症治疗的研究
阿尔茨海默病(AD)是一种起病隐匿的进行性发展的神经系统退行性疾病。Aβ肽纤维的形成是AD中常见的生化特征,被认为是一种假定的致病因素。研究靶向Aβ肽的VHHs,可用于开发新的治疗方法。
研究人员从一个非免疫的、抗Aβ的噬菌体展示文库中筛选出VHHs ni3A和ni8B[7]。随后证明,两种VHHs在体外比FC5(图9)表现出更有效的血脑屏障交叉能力。在另一项关于这两个VHHs的研究中,在框架区(FR1)中有三个氨基酸,ni3A表现出更高的迁移能力,说明氨基酸序列可能是其穿过BBB的关键。基于这一假设,该项目的研究人员将ni3A的FR1与另一个缺乏跨越血脑屏障能力的VHH va2E的CDR1-FR4结合,构建了一个新的VHH 3A2E[6]。随后的体外血脑屏障传代实验表明,新型VHH 3A2E相比VHH va2E具有更高的迁移率。进一步的实验在排除了年龄、疾病和高剂量导致血脑屏障中断的可能性后证明了VHHs能够在体外和AD小鼠模型中能够穿过血脑屏障。
其他团队的研究人员[8]从两个免疫的噬菌体展示VHH文库中筛选出靶向Aβ肽的VHH—R3VQ和靶向磷酸化tau蛋白的VHH—A2。研究发现,两者都与大脑靶点的细胞外(淀粉样斑块)和细胞内(神经纤维缠结)有特异的结合。此外,进一步的实验证明了VHHs能够在体外穿过血脑屏障的能力并在静脉注射的AD小鼠模型中,排除了年龄、疾病和高剂量导致血脑屏障中断的可能性。虽然,VHHs的快速血液清除率和相对较高的肾脏潴留可能会损害体内结果及其在治疗中的应用,但它们可以进一步发展为很有前途的不同淀粉样蛋白沉积的诊断工具。
小结
传统抗体给药的方式受到限制,比较单一。相较于传统抗体,纳米抗体独特的理化性能优势,使更多的给药方式可通过其实现,相信随着免疫疗法和工艺技术的进展,纳米抗体药物在未来将有更多的临床应用。
参考资料:
[1]Arghavan Soleimanizadeh, et al. Central Nervous System Delivery of Antibodies and Their Single-Domain Antibodies and Variable Fragment Derivatives with Focus on Intranasal Nose to Brain Administration.Antibodies 2021, 10, 47.
[2]Fangfang Chen, et al.Prospects of Neutralizing Nanobodies Against SARS-CoV-2.Frontiers in Immunology.2021;5.
[3]Zhang F, Wei H, Wang X, et al. Structural basis of a novel PD-L1 nanobody for immune checkpoint blockade[J]. Cell discovery, 2017, 3(1): 1-12.
[4]Nurbhai, et al. Oral Anti-Tumour Necrosis Factor Domain Antibody V565 Provides High Intestinal Concentrations, and Reduces Markers of Inflammation in Ulcerative Colitis Patients. Sci Rep 9, 14042 (2019).
[5]Amcheslavsky A,et al. Anti-CfaE nanobodies provide broad cross-protection against major pathogenic enterotoxigenic Escherichia coli strains, with implications for vaccine design. Sci Rep. 2021 Feb 2;11(1):2751. doi: 10.1038/s41598-021-81895-0.
[6]Yang Gao, et al..Single domain antibody‑based vectors in the delivery of biologics across the blood brain barrier: a review.Drug Delivery and Translational Research.2020;10.
[7]Li T, et al. Camelid single-domain antibodies: A versatile tool for in vivo imaging of extracellular and intracellular brain targets. J Control Release. 2016;243:1–10.
[8]Rutgers KS, et al. Diferential recognition of vas cular and parenchymal beta amyloid deposition. Neurobiol Aging. 2011;32(10):1774–83.
了解更多纳米抗体相关内容,可关注<阿帕克生物>微信公众号,获取最新资讯~
