前言
纳米抗体由于其体积小、稳定性优良、亲和力高和制备可行性强,已广泛应用于CAR-T中作为抗原结合域。基于纳米抗体的CAR结构已经在十多个不同的肿瘤特异性靶点上显示了良好的功能。得到的基于纳米抗体的CAR-T或CAR-NK细胞在体内外均显示出抗肿瘤效果。纳米抗体在CAR-T治疗中的应用已经从实验室到床边得到了很好的证明,并在形成更具挑战性的先进CAR-T方面显示出巨大的潜力。
CARs发展简史 [1,2]
嵌合受体最早由Zelig Eshhar和Gideon Gross于1989年提出。他们将αβ-T细胞受体(TCR)的Vα和Vβ区域分别替换为抗体的VH和VL, 构建生成一种人工嵌合TCR,其形式可以是VH-Cα/VL-Cβ或VL-Cα/VH-Cβ,如图2所示。这种嵌合TCR,能够以MHC非依赖性方式结合靶细胞并通过TCR机制激活细胞。
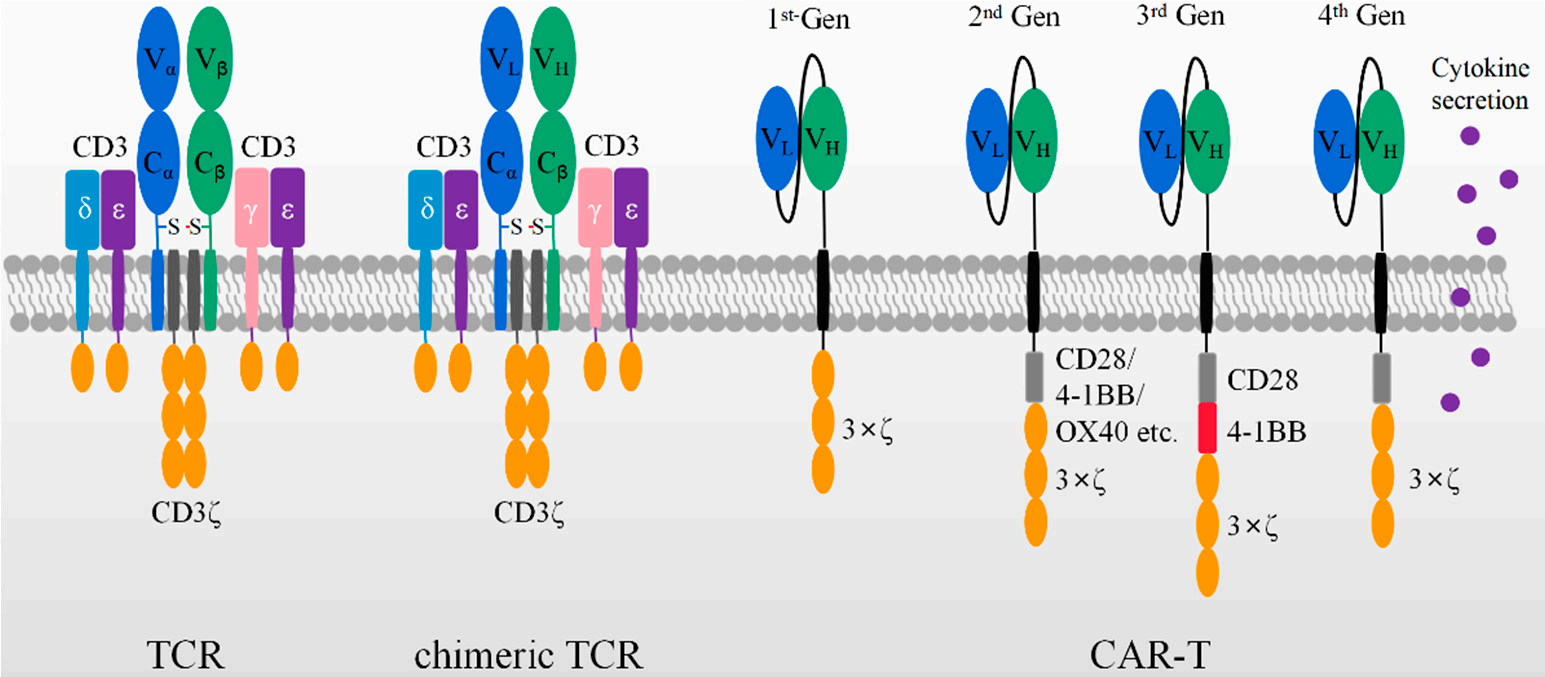
图1. TCR、嵌合TCR以及不同代scFv作为CAR结构域的示意图[2]。
现在所使用的CARs由四个组成部分组成:细胞外抗原识别结构域(包括单链抗体片段scFv或纳米抗体VHH);结构成分,如铰链和跨膜结构域;提供维持CAR-T细胞效应器功能的共刺激信号结构域,以及CD3ζ激活域。
第一代CAR只包含CD3ζ链信号转导结构域。第一代CAR-T细胞虽然在体外和小鼠模型中可以特异性地杀死靶向肿瘤细胞,但是由于肿瘤细胞很少表达共刺激受体配体如B7,而第一代CAR也不具有共刺激受体结构域,因此显示出较低的细胞杀伤活性和体内较短的存留期,不具备临床上的有效性。
第二代CAR在跨膜序列和CD3ξ的ITAM域之间插入共刺激域,例如CD28、4-1BB或OX40。第二代CAR-T表现出优化的T细胞激活、增加的体外抗原依赖性增殖、增强的体内持久性和更有效的抗肿瘤活性。具有CD28或4-1BB共刺激域的第二代CAR目前已经得到很好建立,三种FDA批准的抗CD19 CAR-T细胞都基于这种结构设计。
第三代CAR则加入额外的共刺激域以进一步增强T细胞的激活。典型胞内域由CD28/4-1BB/CD3ξ 或CD28/OX40/CD3ξ组成。临床试验表明,与第二代CAR相比,携带第三代CAR的CAR-T细胞展现出更强的扩增和更长的存活时间,尤其是对于病情轻微和正常B细胞水平较低的患者[3]。
第四代CAR添加分泌细胞因子或抗体能力,通过调节肿瘤免疫微环境以增强其抗肿瘤活性。第四代CAR-T细胞将CAR-T细胞的直接抗肿瘤功能与肿瘤部位释放细胞因子的免疫调节能力融合在一起,避免了系统性给药引起的细胞因子不良影响,并且有望用于实体瘤的靶向治疗。
第五代CAR是基于第二代CAR设计的,在其胞内结构域添加了细胞因子受体。
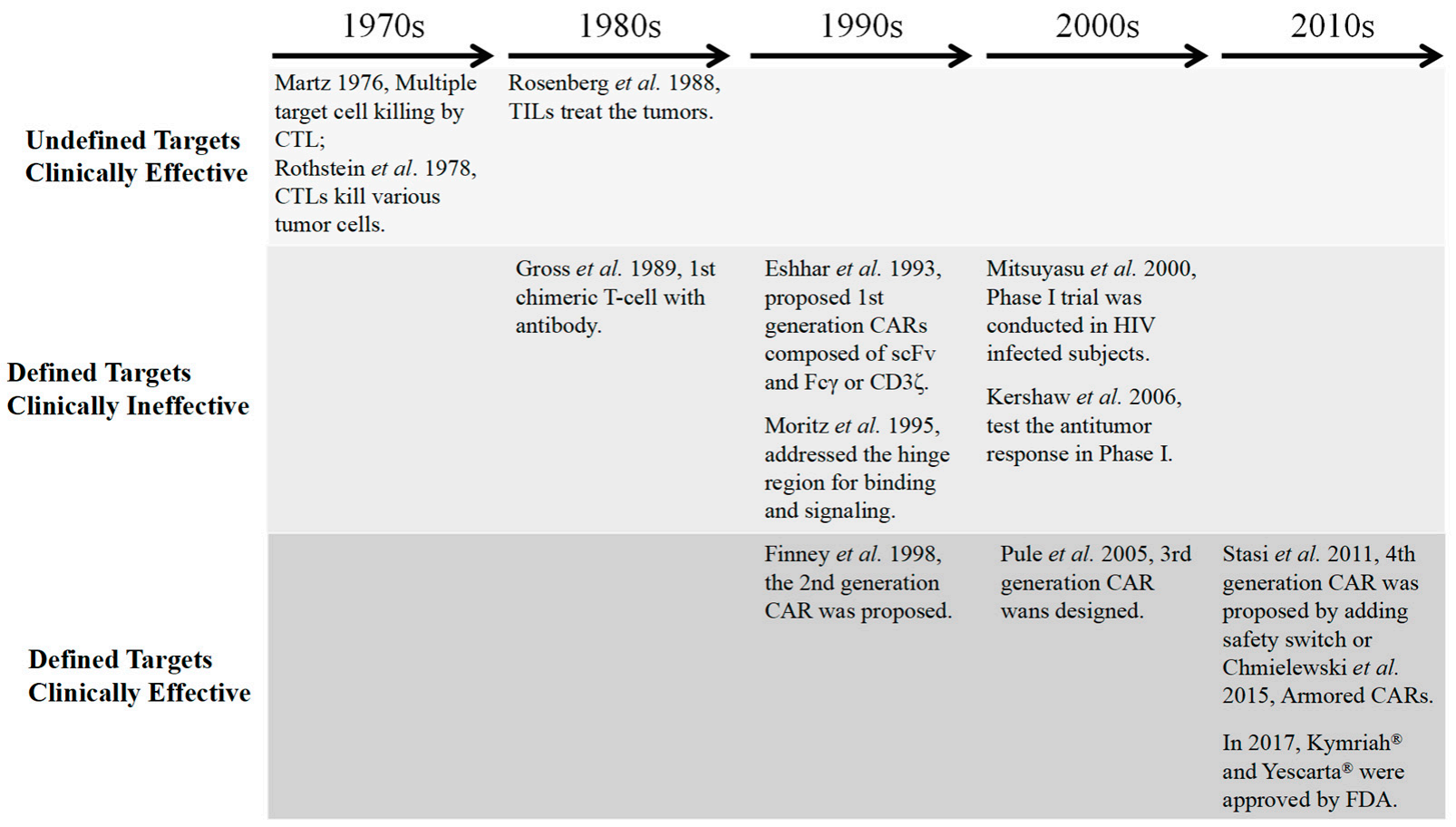
图2. 细胞免疫治疗从实验室到临床的简要发展历程[2]。
纳米抗体替代scFv作为CAR的靶向结构域的优势
无聚集风险
scFv作为CAR容易在细胞表面聚集触发效应细胞的激活和细胞毒性信号级联,导致T细胞枯竭。scFv高自聚集趋势的主要原因有重链可变区上暴露的自由疏水残基,和VH/VL区域不稳定性折叠。相反,基于VHH的CAR-T细胞没有这种风险。
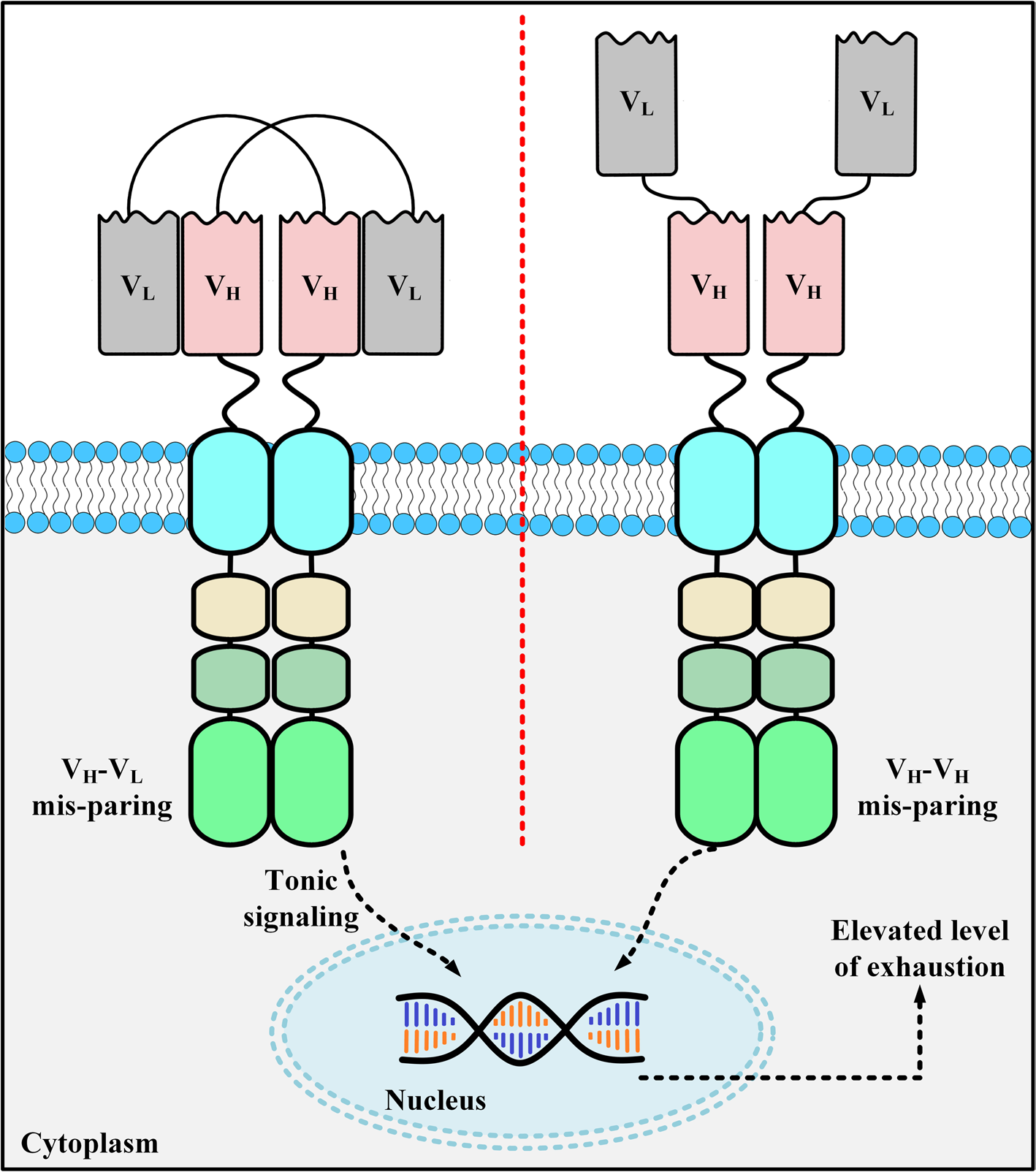
图3. CAR-T表面的scFv聚集示意图[1]。
导致scFv聚集在CAR-T表面上的两种机制。第一种(左)称为VH-VL错配,一个CAR的VL域与另一个CAR的VH域之间的配对。第二种(右)称为VH-VH配对,一个CAR的VH域与另一个CAR的VH域发生配对。
低免疫原性
scFv结构中连接VH和VL的连接肽序列,以及鼠源抗体的骨架序列,会导致免疫原性风险,引起体内产生抗药物抗体(ADA)。ADA效应可能会中和CAR-T细胞的功能,引起严重的副作用,CAR-T细胞丢失,甚至CAR-T治疗失败。与之相比,VHH不需要连接肽,并且VHH与人类VH(VH3基因家族)的序列相似性高达75-90%,因此免疫原性的风险不太可能发生。
双特异性CAR
scFv的结构限制了构建更复杂CAR的潜力。构建双特异性CAR时,两个独立scFv分子中VH和VL的交叉配对可能导致亲和力降低,并且多个scFv插入基因的大小影响病毒包装效率。VHH比容易出现错配的scFv更有利构建为双特异行CAR的靶向结构域,而且转染和病毒包装的效率也要优于scFV。
除了以上优势之外,VHH在抗原表位结合、溶解度和稳定性方面也具有更有利的结构。由于这些特性,VHH在开发各种形式的CAR-T方面具有独特的潜力。
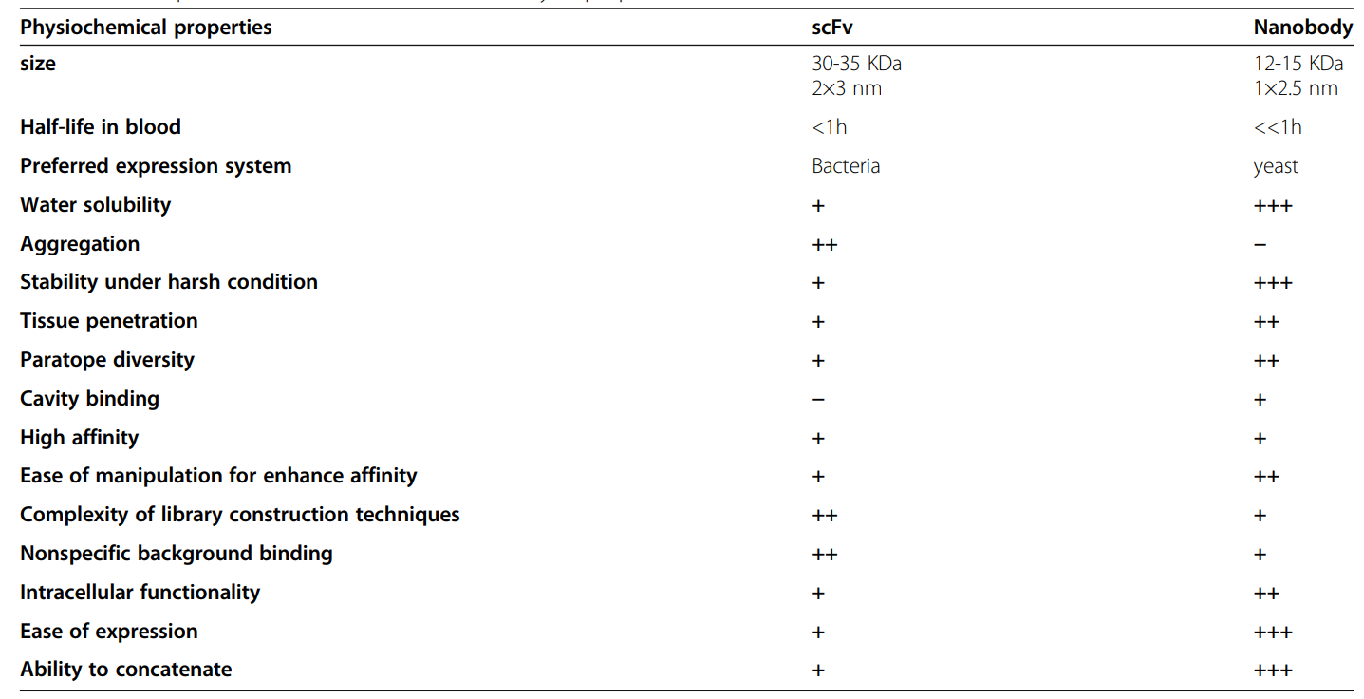
图4. scFv与VHH综合对比。图片来源https://doi.org/10.1186/s40364-021-00332-6
纳米抗体在CAR-T治疗领域的研究进展
基于纳米抗体的CAR
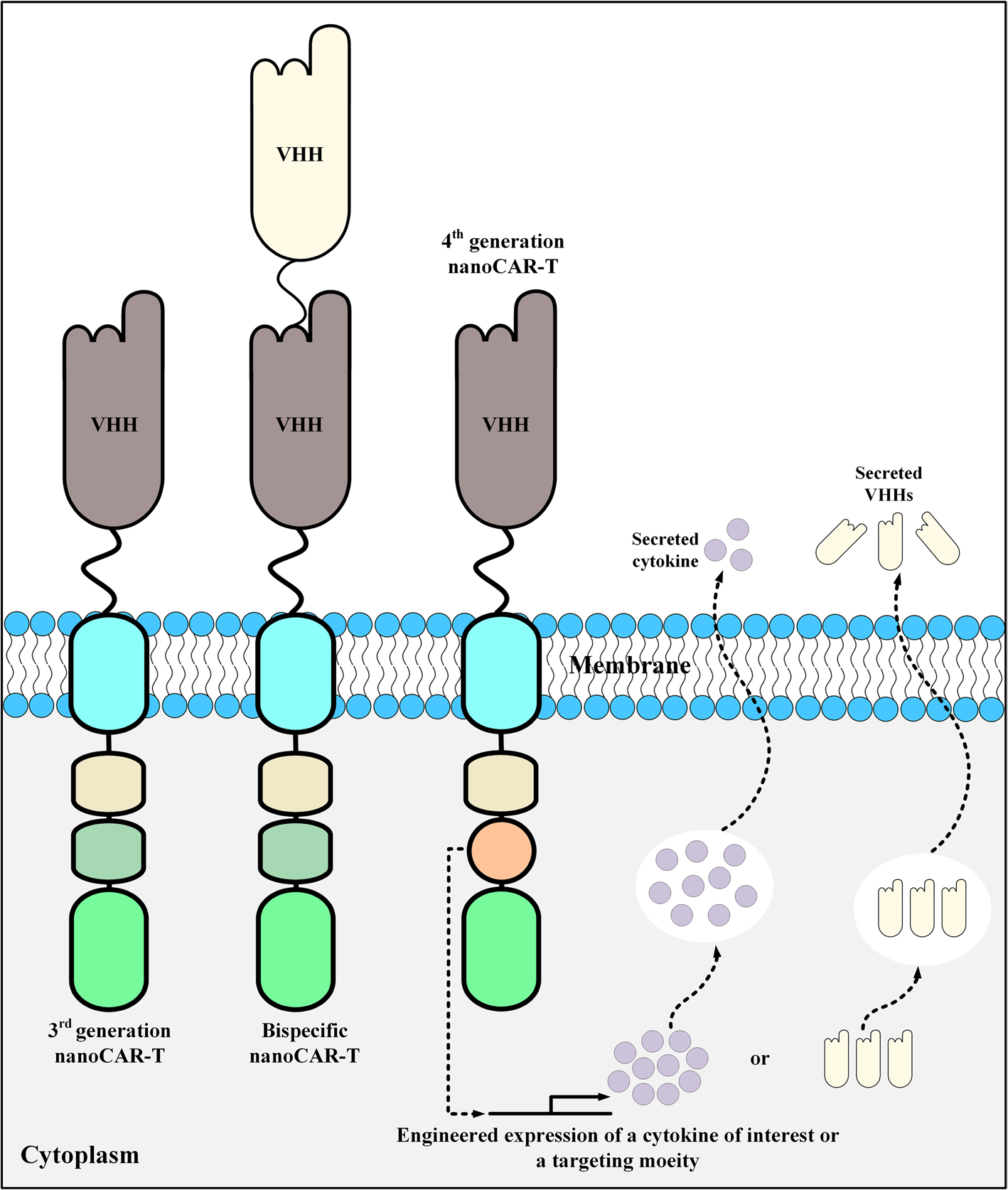
图5. 纳米抗体作为靶向结构域的CAR-T设计示意图
BCMA是一种跨膜激活剂和钙调节因子,在B细胞成熟和分化成浆细胞过程中发挥重要作用。由于恶性浆细胞表达BCMA水平较高,因此成为各种癌症免疫治疗的重要靶点。传奇生物的西达基奥仑赛(Cilta-cel,研发代号:LCAR-B38M)于2022年获FDA批准,用于治疗成人复发/难治性多发性骨髓瘤(MM),是中国首个获FDA批准的细胞治疗产品,同时也是全球首款批准的纳米抗体作为靶向结构域的CAR-T。
Cilta-cel采取独特的二价纳米抗体设计,临床数据显示,平均12.4个月随访期,总缓解率ORR高达97%,sCR高达67%,12个月无进展生存率为77%,12个月总生存率为89%。Cilta-cel的批准上市表明使用纳米抗体开发和制造双特异性/二价CAR-T细胞是可行的。
除了已获批的Cilta-cel使用了纳米抗体作为CAR-T靶向结构域外,目前,关于纳米抗体CAR-T靶向结构域的研究在多个热门靶点均有涉及,包括VEGFR2、HER2、PSMA、TAG-72、GPC2、CD38、CD33、CD7、MUC1、EGFR、CD20、CD105、PD-L1和EIIIB等。

图6. 使用纳米抗体作为靶向结构域的CAR-T靶点[2]。
基于纳米抗体的靶向模块
UniCAR T细胞是一种基于CAR技术的改进型T细胞治疗方法。与传统CAR T细胞不同的是,UniCAR T细胞并不直接与肿瘤细胞结合,而是通过与靶向模块结合重定向到特定的细胞表面抗原。由于纳米抗体分子小,可以更容易地渗透到肿瘤组织中,制备和合成更加灵活,因此是很好的靶向模块选择。研究数据也表明基于双价VHH的靶向模块能够将表达UniCAR的T细胞重定向到表达EGFR抗原的低水平癌细胞[4]。
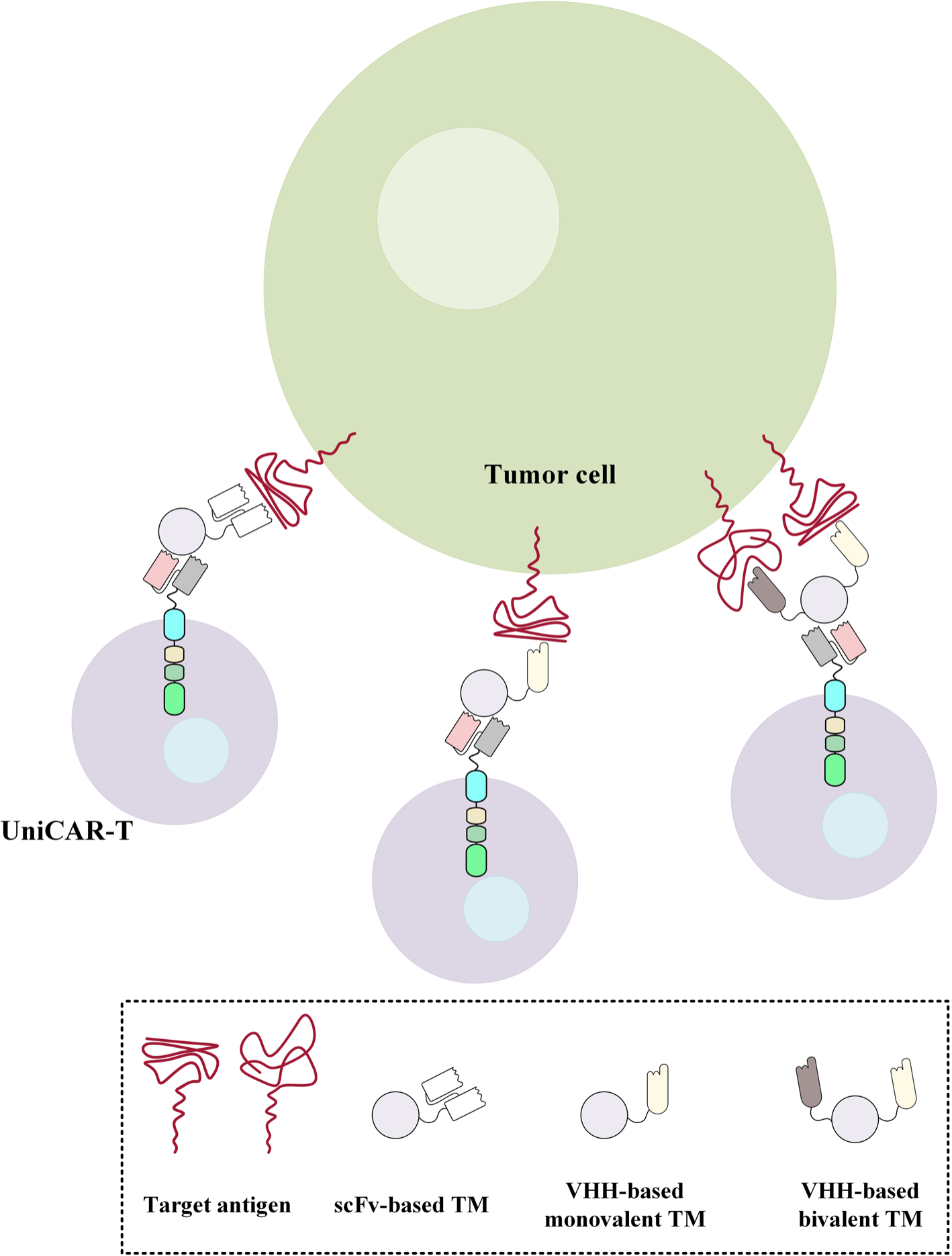
图7. 使用基于scFv、单价VHH和双价VHH的靶向模块来重定向表达UniCAR的T细胞,以靶向特定的目标抗原[1]。
自分泌纳米抗体的CAR-T
目前全球已有多款CAR-T药物获批上市,但都是针对血液系统肿瘤,而实体肿瘤患者众多,肿瘤局部微环境更复杂。第四代CAR-T有望通过自分泌抗体或细胞因子来调节实体瘤肿瘤免疫微环境以增强其抗肿瘤活性。其中进展最快的是上海细胞治疗集团自主研发的自分泌PD1纳米抗体MSLN-CAR T细胞产品(BZD1901),于今年3月份获批临床。该产品通过静脉输注给药,回输的CAR-T细胞在识别肿瘤抗原后被激活,通过细胞毒性作用杀伤肿瘤细胞,同时释放PD1纳米抗体,与T细胞表面PD1进行结合,阻断PD-1/PD-L1信号,改变抑制性的免疫微环境,发挥协同作用杀伤肿瘤细胞。
小结
纳米抗体是细胞治疗领域中一种新兴的、可塑性强的工具。与传统单链抗体相比,纳米抗体更容易穿透肿瘤细胞,能够更好地识别肿瘤靶点并产生抗肿瘤效果。纳米抗体还可以被用来构建多功能的CAR-T细胞,通过针对多个靶点,提高治疗的疗效和安全性。此外,纳米抗体还可以作为UniCAR-T的靶向模块,对CAR-T细胞进行动态调节和监测。随着对其研究的深入,相信纳米抗体在细胞治疗相关应用将会越来越广泛。
参考文献:
[1].Safarzadeh Kozani P, Naseri A, Mirarefin SMJ, Salem F, Nikbakht M, Evazi Bakhshi S, Safarzadeh Kozani P. Nanobody-based CAR-T cells for cancer immunotherapy. Biomark Res. 2022 Apr 25;10(1):24. doi: 10.1186/s40364-022-00371-7.
[2].Bao C, Gao Q, Li LL, Han L, Zhang B, Ding Y, Song Z, Zhang R, Zhang J, Wu XH. The Application of Nanobody in CAR-T Therapy. Biomolecules. 2021 Feb 8;11(2):238. doi: 10.3390/biom11020238.
[3]. Ramos, C.A.; Rouce, R.; Robertson, C.S.; Reyna, A.; Narala, N.; Vyas, G.; Mehta, B.; Zhang, H.; Dakhova, O.; Carrum, G.; et al. In Vivo Fate and Activity of Second- versus Third-Generation CD19-Specifific CAR-T Cells in B Cell Non-Hodgkin’s Lymphomas.Mol. Ther. 2018, 26, 2727–2737.
[4]. Albert S, et al. From mono- to bivalent: improving theranostic properties of target modules for redirection of UniCAR T cells against EGFR-expressing tumor cells in vitro and in vivo. Oncotarget. 2018;9(39):25597–616.
了解更多纳米抗体相关内容,可关注<阿帕克生物>微信公众号,获取最新资讯~
