前言
G蛋白偶联受体(GPCR)作为人体内最大的膜蛋白超家族,调控着细胞对激素,神经递质的大部分应答,以及视觉,嗅觉,味觉等。GPCR在人体内约有850个家族成员,其中一半被认为是潜在的药物靶点。目前FDA 批准的药物中至少有三分之一是针对 GPCR,其中小分子药物占92%,多肽类药物占5%,蛋白类药物占2%,抗体药有2款(Mogamulizumab 和 Erenumab)。据报道,目前上市的药物中,前50种最畅销的药物20%就属于G蛋白受体相关药物,比如充血性心力衰竭药物Coreg,高血压药物Cozaar,乳腺癌药物Zoladex等等。尽管靶向GPCR的药物开发历史悠久,但其结构的灵活性和不稳定性,使得以GPCR作为靶点药物的开发仍具有挑战性。
GPCR结构解析的难点
GPCR的三维结构可以为以GPCR为靶点的药物开发提供指导,然而,相比与数目庞大的GPCR家族蛋白,迄今得到结构解析的GPCR任占极少数。
GPCR结构解析的难点在于[1],第一如何获得大量的蛋白。晶体结构解析需要毫克级别的蛋白,GPCR是7次跨膜蛋白,且部分GPCR在天然组织内表达量低,难以通过传统蛋白纯化的方法获得,而膜蛋白重组表达技术尚存诸多难点,因此研究者们需要开发异源重组表达和纯化的方法。第二如何稳定受体的构象。GPCR针对激素和神经递质的信号感知与传递功能归因于它们灵活多变的可塑性结构。GPCR可以以多种功能上不同的构象状态存在。尽管这种结构可塑性和动态行为对于GPCR功能是必需的,但是也成为获得高分辨率稳定状态晶体结构的障碍,而要获得稳定的活性状态下的晶体结构难度更大,这是因为没有G蛋白结合的GPCR活性构象是极不稳定性。
VHHs用于GPCR结构解析
在GPCR结构解析领域中做出杰出工作的科学家之一是来自美国斯坦福大学的Brian K. Kobilka教授。他也是ConfometRx的共同创办人,一家专注于GPCR的生物技术公司。2011年Kobilka教授领导的国际研究团队报道了agonist-β2AR-Gs 三元复合体的详细晶体结构,这一发现被称为是一项真正具有突破意义的成果。因在β2AR受体上做出了突出贡献,Robert J. Lefkowitz 和 Brian K. Kobilka 于2012年被授予诺贝尔化学奖。
VHH Nb80锁定GPCR的活性状态构象
β2AR是一类交感神经系统的膜蛋白受体,利用内源性儿茶酚胺如肾上腺素和去甲肾上腺素等激动剂参与人体许多生理和代谢过程。β2AR作为药物靶点,可用于哮喘、心血管等疾病的治疗。因此,获得β2AR晶体结构显得尤为重要。Kobilka研究小组与合作者一起在2007年连续发表了多篇β2AR的晶体结构文章。但是这些结构捕捉的都是β2AR结合拮抗剂的非激活状态。
2011年,Kobilka研究小组应用纳米抗体技术才首次获得活性状态下的β2AR晶体结构[2]。在这项研究工作中,Kobilka研究小组将纯化的agonist-β2AR复合物以高密度包装在磷脂载体中,以此为抗原免疫美洲驼,经筛选得到结合特性类似于G蛋白的纳米抗体Nb80,即结合激活状态下的野生型β2AR和β2AR-T4L (β2AR-T4溶菌酶融合蛋白用于获得高分辨率晶体结构)。
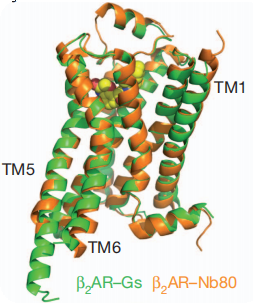
通过激动剂竞争性结合实验,Kobilka研究小组检测Gs(G蛋白异源三聚体)和Nb80对β2AR的激动剂亲和力的影响。将β2AR蛋白包装在HDL载体中,在没有Gs或Nb80存在的情况下。 异丙肾上腺素(isoproterenol,β2AR的激动剂)的抑制常数(Ki)为107 nM。有Gs存在的情况下,有两种亲和力状态,因为并非所有的β2AR都与Gs结合(除了经典的G蛋白信号传递途径,目前GPCR公认的信号传导途径还有β-arrestin依赖性的信号传导途径)。在Gs结合状态下,异丙肾上腺素对受体β2AR的亲和力增加100倍(Ki = 1.07 nM)(图1D)。同样地,在Nb80结合β2AR的情况下,异丙肾上腺素对受体β2AR的亲和力增加了95倍(Ki =1.13 nM)(图1E)。相反,Nb80对β2AR与反向激动剂ICI-11的结合没有什么影响。这些结合数据表明,Nb80结合β2AR后形成的稳定活性构象与通过Gs稳定的构象非常相似,Nb80完美地模仿再现了agonist-GPCR-Gs的三元复合体模型,证明其具有与Gs蛋白类似的功能。不仅如此,Kobilka研究小组同年发表的另一篇文章中[3],从Gs和Nb80分别结合的β2AR晶体结构对比图(图2)能够看出,二者各自结合β2AR后所捕获的β2AR活性构象仅有略微的差别。
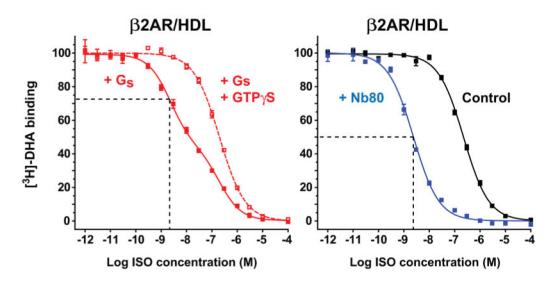
图1. Gs(the stimulatory G protein)和Nb80对β2AR的激动剂亲和力的影响。
接着,研究者将Nb80-β2AR与小分子完全激动剂BI-167107结合,在脂立方相( Lipidic cubic phase,LCP) 中获得有活性的3. 5Å分辨率的 β2AR-T4L-NB80 复合物晶体结构(图3)。从晶体结构中可以看到Nb80与β2AR的胞质端结合,并且Nb80的CDR3 loop伸向β2AR的核心部位。活性构象的β2AR-T4L-Nb80与失活状态的β2AR质端向外移动11Å以及跨膜段5(TM5)和跨膜段7(TM7)的重新排列有关,这与在视蛋白opsin(一种活性形式的视紫红质)中观察到的非常相似。通过纳米抗体Nb80捕获到活性状态下β2AR的晶体结构加深了我们对激动剂结合和激活过程的了解。
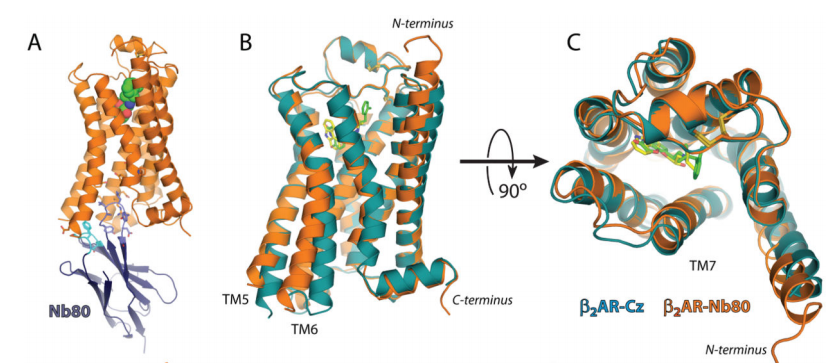
图3. 激动剂-Nb80稳定的活化β2AR晶体结构与反向激动剂结合的β2AR的比较
反向激动剂Carazolol(黄色)与β2AR-T4L结合的结构(β2AR-Cz) 显示为蓝色。激动剂BI-167107(绿色)与Nb80稳定的β2AR-T4L结合的结构 (β2AR-Nb80)显示为橙色。将这两个结构经Pymol align进行对比。
A.β2AR-Nb80复合物的侧视图,Nb80的CDR1(浅蓝色)和CDR3(蓝色)。
B.两种复合物结构叠加的侧视图,显示出受体β2AR的胞内部分(G蛋白结合域)结构比较有显著的变化。
C.受体β2AR的胞外部分(配体结合域)的比较,显示结构变化不大。
VHH Nb35稳定GPCR-Gs的结合构象
Kobilka研究小组在2011年报道的另外一份重磅研究成果,β2AR-Gs的晶体结构[3],同样采用了纳米抗体来稳定复合物的构象,不同与Nb80(模拟G蛋白结合GPCR),这项研究中用到的纳米抗体Nb35用于结合G蛋白异源三聚体(Gs),稳定β2AR-Gs复合物。从获得的3. 2Å分辨率的T4L-β2AR–Gs–Nb35复合物晶体结构中观察到(图4),Nb35插入在Gα亚基和Gβ亚基的交汇面,其CDR1 loop与Gβ亚基相互作用,较长的CDR3 loop则同时与Gα亚基和Gβ亚基相互作用,并且Nb35的框架区也与相邻的Gα亚基发生相互作用。
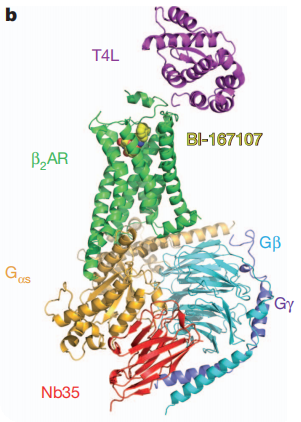
图4. T4L-β2AR–Gs–Nb35整体结构显示β2AR(绿色)与激动剂BI-167107(黄色)结合并与Gα橙色大面积结合。Gα与Gβ(青色)和Gγ一起(紫色)构成G蛋白异源三聚体(Gs).
Nb35参与捕获的β2AR–Gs复合晶体结构是GPCR跨膜信号传导的第一个高分辨率视图,为GPCR:G蛋白复合物的形成,GTP结合以及复合物解离过程中的机制研究提供了重要的框架。深入了解GPCR:G蛋白活化的结构基础将为药物发现提供新的可行方法。继这篇重磅研究之后,Kobilka教授接着对β2AR多种状态做了构效关系的研究。除此之外,通过类似的思路,他们还对GPCR B类受体等蛋白做了结构解析。2014年,Kobilka教授实验室发表综述,总结了用于稳定GPCR蛋白构象的纳米抗体的筛选流程[4]。
VHHs将GPCR锁定在可成药构象中加速靶向药物发现
随着β2AR多种状态下的晶体结构的成功捕获,在促进人们对GPCR参与信号传导机制理解的同时,富有想法的科学家们延续纳米抗体在GPCR研究领域的优势,并将其发展为靶向GPCR的药物发现关键平台之一。比如Confo Therapeutics公司,人员组成中不仅拥有多位Ablynx前员工,也包含参与2011年β2AR结构解析工作的科学家。
Confo Therapeutics公司核心技术平台设计的原理是使用VHHs将GPCR以及GPCR:Gs信号转到复合物稳定在与疾病相关的药理构象状态,进而筛选出更具选择性和有效性的候选药物分子。该公司将可稳定构象的VHHs统一命名为ConfoBodies(简称Cbs),并分为三类[5]。I型Cbs是模拟G蛋白的VHHs,它直接与激活的GPCR的胞内环相互作用,稳定活性构象(图5,A)。II型Cbs是直接与非活化的GPCR的胞内环结合并稳定非活性构象。III型Cbs是稳定GPCR:Gs信号转到复合物的VHHs,通过与Gs信号蛋白相互作用,间接稳定GPCR:Gs信号转到复合物的活性构象(图5,B)。

图5. ConfoBodies(Cbs)的作用模式图。
2018年Jan Steyaert研究小组 (2011年β2AR晶体结构解析工作的作者之一)发表的文章也展示了这种基于VHHs的药物发现设计[6]。在放射性配体竞争实验中,研究者对比活性构象的β2AR-Nb80复合物相对于基础活性构象 (basal activity)的β2AR-Nbirr对激动剂小分子和拮抗剂小分子与受体β2AR亲和力的差异(图6)。结果显示,G蛋白模拟物Nb80 有效地将β2AR锁定在活性状态构象(图6 A)。
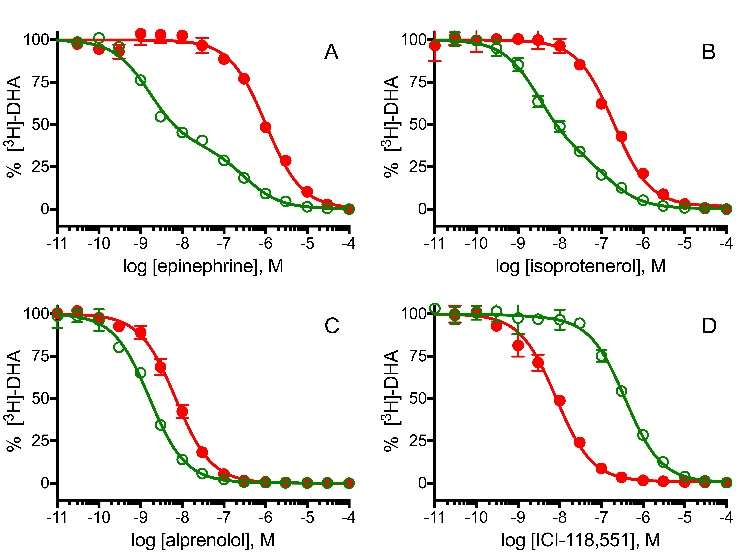
图6. 放射性配体竞争实验。激动剂、拮抗剂和反激动剂不同程度地取代了放射性标记的拮抗剂[3H]-二氢肾上腺素([3H]-DHA)结合到受体的原始状态(β2AR-Nbirr,closed red symbols)和活性状态(β2AR-Nb80,open green symbols)。
(a)-(b) β2AR与Nb80结合将受体β2AR稳定在高亲和力的活性状态,与原始状态(β2AR-Nbirr)相比,β2AR-Nb80对配体Epinephrine(肾上腺素)和Isoprotenerol(异丙肾上腺素)的结合强度提高约2000倍。
(c) Alprenonol(丙烯醇),一种中性拮抗剂,与β2AR-Nb80和β2AR-Nbirr的结合强度相当。
(d) β2AR反向激动剂如ICI-118,551优先结合受体的基础状态,而不是活性状态。
通过这种便捷的设计,研究者在纳米抗体的参与下将受体β2AR稳定在活性或基础构象状态下,然后测量配体结合亲和力的变化,可用于对多种新型激动剂进行鉴定和排序,并可进行激动剂、拮抗剂或反激动剂的功效分类。紧接着Jan Steyaert研究小组通过单点放射性配体置换试验,对1000个小分子(分子量在80-300 Da且少于三个氢键供体或受体的小分子)进行筛选,检测它们与受体的激活状态(β2AR-Nb80复合物)和基础状态(β2AR-Nbirr复合物)的结合(图7)。经这种比较筛选,发现了大量的片段优先结合活性状态的受体(β2AR-Nb80复合物),表现出与β2AR激动剂类似的结合特性。而其他与β2AR-Nb80和β2AR-Nbirr的结合强度相当的小分子,或优先结合基础活性状态的小分子,则分别类似于拮抗剂或反向激动剂。
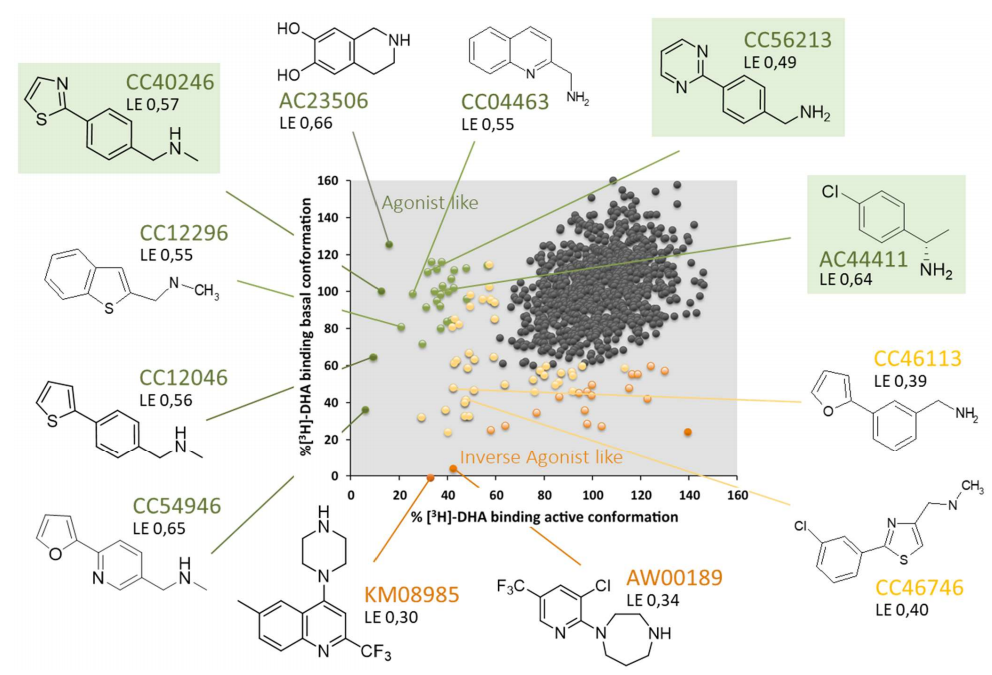
图7. 对β2AR的激活态和基础态进行基于小分子片段的比较筛选。每个点测量的是放射性配体([3H]-DHA)在受体激活状上的剩余结合(X轴),与受体基础状(Y轴)上的剩余结合。绿色突出显示的小分子被选中进行表征。
接下来研究者从高选择性结合激活态β2AR的小分子中选出3个(CC40246、CC56213和AC44411)用于评估这种生化筛选特定分子片段的方法是否可以作为设计强效激动剂的起点。为了实现结构的多样性和覆盖不同的拓扑学和化学空间,在计算工具的帮助下,基于选定的小分子,研究者设计出一组衍生的小分子化合物(文献6补充材料)并进行功能评估(图8)。
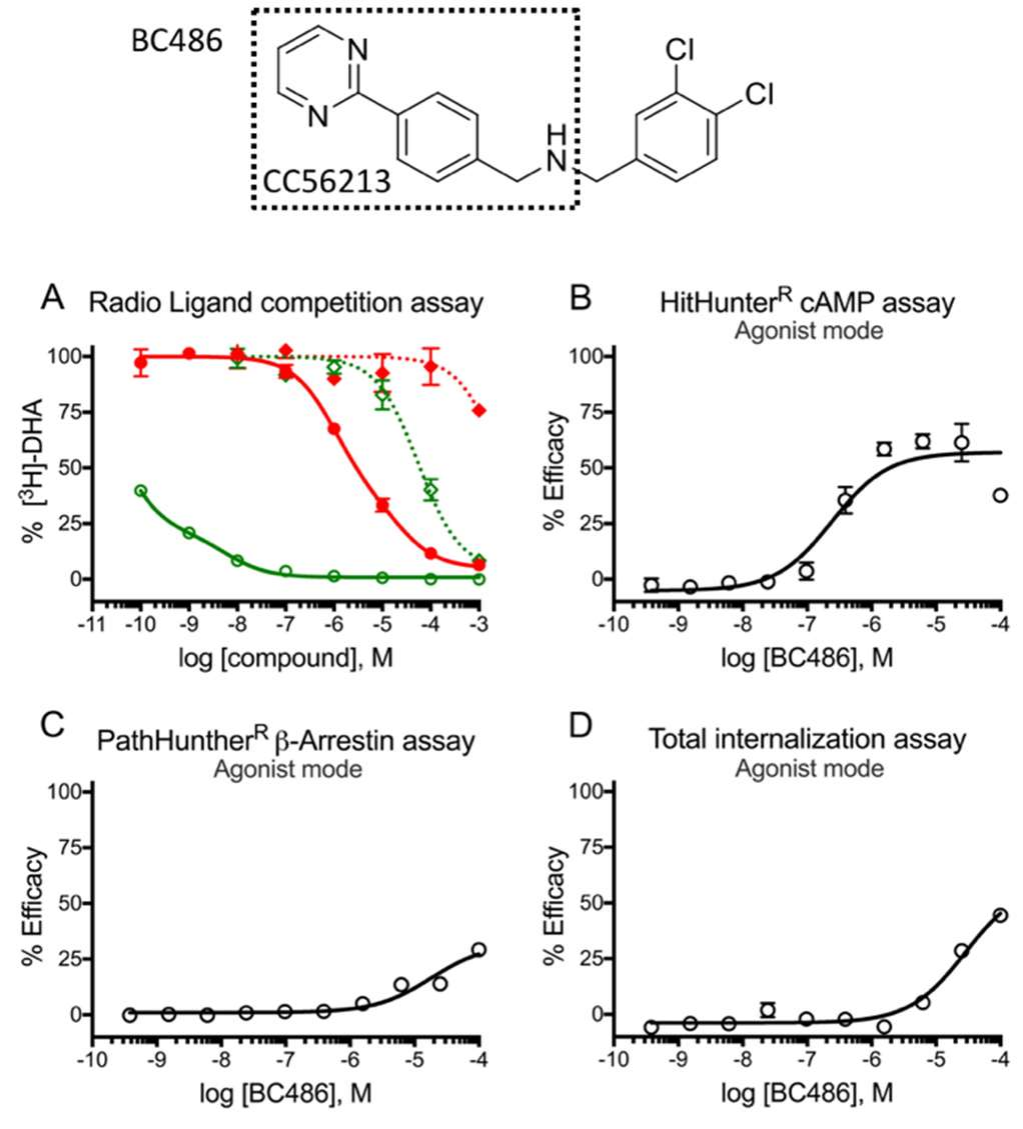
图8. 基于CC56213设计的代表性衍生化合物BC486的功能评估。放射性配体竞争实验和三个激动剂模式下的细胞试验。
(a) 在使用放射性[3H]-DHA示踪剂的配体竞争实验中 BC486(circle)与设计它所参考的原始化合物CC56213(diamonds)功能相似,都是优先结合激活状态的β2AR-Nb80(绿色曲线)而不是基础状态的β2AR-Nbirr(红色曲线)。
(b) β2AR HitHunther cAMP assay检测 BC486诱导的cAMP积累
(c) β2AR PathHuntherβarrestin assay检测BC486引起的βarrestin的招募。
(d) PathHunter® Activated GPCR Internalization assay检测BC486引起的β2AR内吞。
功能实验显示选出的高亲和力的片段衍生化合物对 β2AR-Nb80 表现出pM亲和力并且区分激活状态与基础状态的亲和力相差四个数量级,接近β2AR受体的全动态激活。这些片段衍生的化合物在细胞测定中也都展示出相似的功能。
小结
GPCR作为生物体中表达和功能最广泛的一类蛋白,是重要的药物靶点。在GPCR结构解析和信号传导机制研究工作中,纳米抗体技术的应用起到至关重要的作用,纳米抗体捕获GPCR的功能构象状态、特别是其活性构象状态,从而允许对GPCR进行结构和功能分析,包括高分辨率结构分析和由其衍生的许多其他应用。目前,已有多个研究团队将纳米抗体用于建立构象选择性片段的靶向GPCR的候选分子筛选分析和发现,以从中得到具有理想的体外药理学和效力的分子。纳米抗体成为扩展药物发现的工具箱,将大力促进GPCR靶向性的新结构药物的开发。
参考资料:
[1]. https://fanpusci.blog.caixin.com/archives/252858
[2]. Rasmussen. et al. Structure of a nanobody-stabilized active state of the β2 adrenoceptor.
Nature 469, 175–180 (2011). https://doi.org/10.1038/nature09648
[3]. Rasmussen. et al. Crystal structure of the β2 adrenergic receptor–Gs protein complex.
Nature 477, 549–555 (2011). https://doi.org/10.1038/nature10361
[4]. Pardon, E., Laeremans, T., Triest, S. et al. A general protocol for the generation of Nanobodies for structural biology.
Nat Protoc 9, 674–693 (2014). https://doi.org/10.1038/nprot.2014.039
[5]. Laeremans T. et al. Accelerating GPCR Drug Discovery With Conformation-Stabilizing VHHs. Front. Mol. Biosci. 9:863099(2022). doi: 10.3389/fmolb.2022.863099
[6]. Pardon, Els. et al. Nanobody-Enabled Reverse Pharmacology on G-Protein-Coupled Receptors. Angewandte Chemie (International ed. in English) vol. 57,19 (2018): 5292-5295. doi:10.1002/anie.201712581
了解更多纳米抗体相关内容,可关注<阿帕克生物>微信公众号,获取最新资讯~
