前言
随着单分子定位的超分辨率显微镜的最新发展,在低于衍射极限的分辨率下,对细胞结构成像已经成为一种广泛的技术。纳米抗体的小尺寸、易于生产和基因工程使其成为生物医学成像和分子治疗的很有前途的应用工具。已经有许多研究证实了将纳米抗体带上标签后,可以用作纳米级的检测工具。例如,针对GFP和RFP等荧光蛋白的纳米抗体,在标记上有机染料后可用于细胞骨架成分的超分辨率显微镜成像。本文将为大家介绍纳米抗体在单分子定位的超分辨率显微镜中的技术应用。
传统有机染料在荧光显微成像中的局限
近年来,随着一些突破性的荧光超分辨率成像方法的发展,光学分辨率的极限已被降低到几纳米。其中,单分子定位显微镜(single-molecule localization microscopy,SMLM)技术已经能够以前所未有的分辨率对荧光标记的特征进行展示,并且越来越多地用于解释亚细胞的组织结构。
荧光显微镜由于相对简单和快速的样品制备、显著的对比度和高度的特异性,在可视化生物分子相互作用上具备巨大潜力。然而,由于SMLM技术的性质决定了SMLM需要特定、有效的明亮的荧光团输送到目标结构的近距离,而不增加过多的背景。
在传统的间接免疫荧光法中,染料可以通过抗体来传递,目标表位用一抗修饰,然后用荧光标记的二抗检测,但是它们的大尺寸(约12-15 nm)会使染料和表位之间产生约10nM的"连接误差",因此降低了超分辨率荧光显微镜可实现的蛋白质定位精度和准确性。而且高度特异的抗体只适用于某些特定蛋白质。基于光活化荧光蛋白或酶标记方案的方法则需要生产新的融合构建体,但这些构建体需要被定性,而最终结果可能没有功能活性。同时由于SMLM依赖于数千个单个分子的分辨率,其限制因素是目标分子的标记成功率。虽然现有的荧光团如Alexa Fluor 647(AF647)提供了足够的光子用于样品中染料定位的高精度,但最终图像是否能准确地表征目标结构在很大程度上取决于其递送的效率和准确性。如果染料没有被输送到目标结构附近或与细胞结构非特异性结合,则会导致显著的畸变。
纳米抗体在细胞超微结构研究中的应用及优势
相比于使用全长抗体传递有机染料的荧光成像传统方法,体积更小的纳米抗体介导的有机染料靶向目标分子,既保有目标特异性和高亲和力,也具备最小的连接误差。
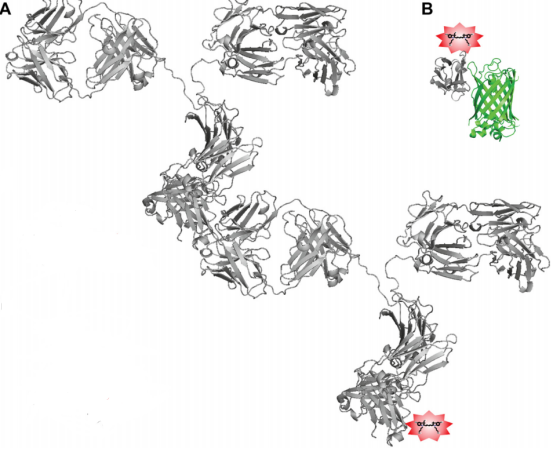
图1 . 将有机染料输送到目标结构上的方法。
A.荧光团通过用目标特异性一抗和二级标记抗体进行间接标记来将荧光团传递到目标结构的。
B.荧光团与一个高度特异性的抗GFP纳米抗体的结合,使染料更接近GFP基因标记的目标结构。
1. 纳米抗体增加在标记结构中的标记密度和分辨率
研究者使用不同的免疫荧光法观察细胞环境中密集多组分组件的成像。核孔复合体(NPC)是一种高度排列的圆柱形多蛋白结构,分子量110 MDa,外径为120nm。这种超大尺寸对任何结构和功能研究都构成了巨大挑战。研究者使用EGFP标记核孔蛋白Nup43,并通过AF647标记的抗GFP纳米抗体进行SMLM成像。可以在固定细胞的细胞核下表面看到直径为100nm的环状结构,这与Nup43 的预测位置一致(图.2A )。在某些情况下,甚至可以观察到中央旋转的八倍对称排列。而传统的间接免疫荧光法(一抗GFP抗体和二抗小鼠抗体)观察Nup43-EGFP(图.2B) 的图像虽然包含NPC的定位,但几乎不能观察到完整的环形结构,可能原因是由于在核孔复合体的密集环境中,相对较大的抗体标记形成了一定的的空间位阻。因此,小体积的纳米抗体在拥挤的细胞环境中可提供优越的表位可及性。

图2.纳米抗体和全长抗体标记核孔复合体的表位可及性差异比较。图像显示了稳定表达Nup43-EGFP的固定U2OS细胞,其细胞核的下表面。
A.Nup43-EGFP通过AF647偶联的抗GFP纳米抗体进行标记。
B.Nup43-EGFP标记为一抗GFP抗体和AF647偶联二抗抗体。
2. 纳米抗体的小尺寸可提高标记中的最小分辨率
研究者使用三种不同的策略标记小窝(caveolae),这是由膜相关蛋白 Caveolin 1(Cav1)形成的穴样内陷。首先,使用抗Cav1一抗和AF647标记的二抗来检测大鼠上皮细胞NRK52E细胞中的小窝。当进行SMLM测量时,能够将固定细胞膜上的Cav1组件可视化为平均直径116nm的环,这是膜平面上一个空心杯状凹窝的二维投影(图.3C)。接下来,在NRK52E细胞中瞬时过表达Cav1-EGFP,并使用AF647-抗GFP纳米抗体进行标记,在重建的SMLM图像中看到的小窝形态与图3C相同,但直径更小,为94nm。(图.3D ) 。同时对瞬时转染Cav1-PAmCherry的HeLa细胞的小窝进行了SMLM成像。在重建的SMLM图像中,小窝表现为直径为128nm的点云,仅在少数情况下可见结构呈环状(图.3E )。虽然PAFP基因标记具有较高的标记效率和特异性,三种比较标记方法的连锁误差最小,但PAmCherry的光子产率比AF647低4-5倍,导致定位精度大约低两倍。上述的观察结果证明纳米抗体标记允许在SMLM测量中分辨出更精细的细节。
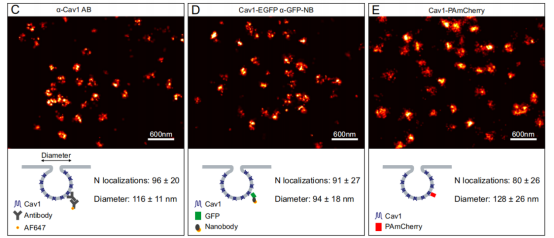
图3. (C-E)使用不同的标记策略获得的固定细胞基底膜上的小窝的超分辨率图像。
C.通过兔抗Cav1抗体和二级AF647偶联抗体标记的NRK52E细胞中的小窝。
D.Cav1-EGFP在用AF647-抗GFP纳米抗体标记的NRK52E细胞中瞬时表达。
E.HeLa细胞中Cav1-PAmCherry的PALM图像。
3.双色纳米抗体可在SMLM进行准确的共定位分析
使用纳米抗体进行双色SMLM,这种方法为两种颜色都提供了高分辨率,最小限度地减少了串扰,并且没有色差,总体上允许在SMLM 中进行非常准确的共定位分析。研究者对固定细胞质膜上的小窝进行了双色成像,通过观察多蛋白结构的两个不同组分证明纳米抗体标记的质量。用Cav1-EGFP和Cav1-mCherry共转染人U2OS细胞,用AF647-anti-GFP和CF680-anti-RFP纳米抗体进行标记。重建的SMLM图像显示与预期的一样,这两种融合蛋白在小窝内几十纳米的尺度上共定位,显示出了它们的详细形态(图4.A )。此外,图像还能够分辨出两种颜色的凹窝的空心环状投影,因为在两个通道的横向轮廓中都可以检测到两个间隔小于50nm的峰(图,4B ) 。

接下来,研究者挑战了两个紧密间隔、内化小窝形态成分不同的可视化。Dynamin2是一种GTPase,与小窝结合,作为成熟小窝颈部的裂变环,从质膜内化形成胞质囊泡。Dynamin2的显性负性形式Dyn2K44A是一个不能结合GTP的突变体,抑制小泡裂变,并在质膜上阻止小泡的成熟。Dyn2K44A聚集在不完全收缩的小窝颈部周围。在U2OS细胞中瞬时共表达Cav1-mCherry和Dyn2K44A-EGFP,固定细胞,用AF647-Anti-GFP和Cf680-Anti-RFP纳米抗体标记,可以通过SMLM成像清楚地观察Dyn2K44A-EGFP定位与Cav1-mcherry阳性结构的关联,并发现Dyn2K44A-EGFP染色位于小窝中心的离散点(图.5) 。因此,在单个小窝的侧面轮廓中,Dyn2K44A-EGFP染色显示在Cav1-mCherry的两个峰之间的单峰(图.5)。
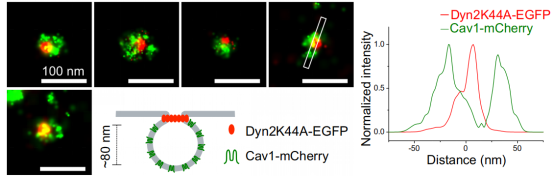
图5.Cav1-mCherry和Dyn2K44A-EGFP的SMLM成像左.两幅包含Cav1-mCherry(绿色)和Dyn2K44A-EGFP(红色)的单个小窝的彩色图像,以及Cav1-mCherry(绿色)在小泡膜上的相对定位和Dyn2K44A-EGFP(红色)的示意图。右.Cav1-mCherry(绿色)和Dyn2K44A-EGFP(红色)的强度曲线显示为以Cav1的两个峰为中心的单峰。
4. 单颗粒示踪(Single particle tracking,SPT)
虽然溶质和膜的结合扩散到特殊形状的刺突被广泛研究,但是这种扩散是如何调节的目前还不完全清楚。如果使用带有染料的纳米抗体标记细胞膜上的目标蛋白,而目标蛋白空间位置可以随着时间的推移以纳米精度确定,这样,跨膜蛋白的运动就可以在单分子水平上进行定量描述。基于这样的构思,研究者利用纳米抗体动态研究神经元树突轴(<2um)蘑菇状突起。研究者在培养的海马神经元的单个刺突中,首先对膜相关的CD4-mRFP进行光漂白(FRAP)实验后的荧光恢复(图.6A和B)。然后,使用Atto647N-anti-RFP纳米抗体进行单颗粒示踪,通过单分子水平的实验补充了这种整体扩散测量(图.6 C )。
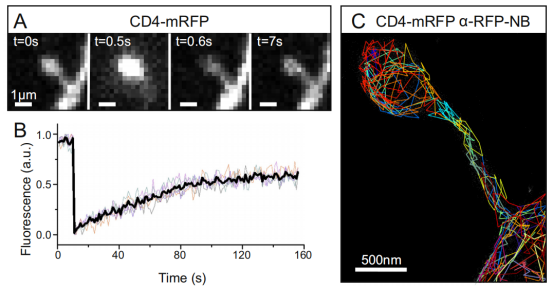
图6. 结合光漂白后的荧光恢复(FRAP)技术和单粒子对表达CD4-mRFP的海马神经元树突棘的跟踪测量。
A.在FRAP实验中记录的图像序列的单帧显示。
B.连续5次FRAP实验获得的彩色荧光恢复曲线和平均值(黑色)。
C.在SPT过程中通过Atto647N-anti-RFP纳米抗体与(A)对应的树突棘上获得的单分子轨道。
5. 纳米抗体用于监测两种不同类型的膜相关分子的横向迁移率
研究者在大鼠内皮NRK52E细胞的质膜中使用L-mHoneydewGT46和GPI-EGFP进行双色单颗粒示踪观察[2]。EGFP通过GPI锚定在质膜上,而L-mHoneydew-GT46是单次跨膜蛋白。mHoneydew是dsRed的一种黄色荧光衍生物,可被抗RFP纳米抗体识别。由于EGFP和mHoneydew都在光谱的绿黄色区域发射,可以使用橙红色Alexa Fluor 555(AF555)和远红色Atto647N的染料。这两种染料都具有优良的量子产率和高光稳定性,因此非常适合于单颗粒示踪,二者的发射光可以用二向分色镜进行光谱分离。当将AF555-anti-RFP和Atto647N-anti-GFP纳米抗体以亚纳摩尔浓度添加到成像缓冲液中时,研究者能够同时追踪它们在双转染细胞的基底膜上的运动(图.7D )。利用此方法,直接对双色单颗粒进行示踪,在一个实验中为两个分子产生了数百个轨迹,并清楚地检测到脂锚定和跨膜分子的膜运动的差异(图.7E和7F)。
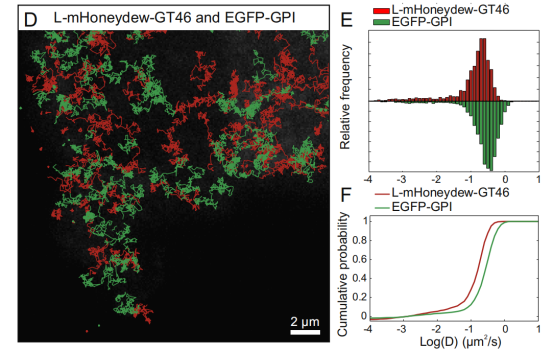
图7.脂锚定和跨膜分子的膜运动的差异
D.L-mHoneydew-GT46(红色)和GPI-EGFP(绿色)在基底膜上的运动轨迹。
E.直方图和F.扩散系数的累积概率图。
小结
纳米抗体介导的标记提供了一种简单和通用的方法来标记几乎任何广泛可用的GFP和RFP衍生的融合结构,可用于先进的单分子成像应用,包括单颗粒示踪和单分子定位显微镜。由于纳米抗体的高亲和力和小尺寸,其优点包括非常精确和一致的标记,以及在复杂和致密的样品中具有优越的可及性。对于SMLM成像应用,样品制备非常稳健,只涉及几个简单的步骤。可在固定后2小时进行成像,缩短实验周期。同时,纳米抗体对固定试剂的选择、可研究的标本数量的增加以及图片切换时所需的还原剂的也不敏感。
此外,使用对抗GFP和RFP的纳米抗体,可以用双色SMLM对任何功能GFP和RFP融合结构的亚细胞进行研究及定位。这使得双色SMLM成像可以很容易地解决无数的生物问题。纳米抗体在SPT测量中的应用,结合光漂白后的荧光恢复,可以更好地了解质膜中蛋白质的全局和局部方面的运动。
纳米抗体相比传统抗体而言不仅拥有更优的理化性质,而且表达和筛选也更加简便。纳米抗体因其小分子,高亲和力,高特异性,稳定性以及低生产成本等特点在生物学和医学领域中实现了多方面的应用。
参考资料:
[1]. Platonova E, Winterflood CM, Junemann A, Albrecht D, Faix J, Ewers H. Single-molecule microscopy of molecules tagged with GFP or RFP derivatives in mammalian cells using nanobody binders. Methods. 2015 Oct 15;88:89-97. doi: 10.1016/j.ymeth.2015.06.018. Epub 2015 Jun 27. PMID: 26123185.
[2]. Albrecht D, Winterflood CM, Ewers H. Dual color single particle tracking via nanobodies. Methods Appl Fluoresc. 2015 Mar 27;3(2):024001. doi: 10.1088/2050-6120/3/2/024001. PMID: 29148490.
了解更多纳米抗体相关内容,可关注<阿帕克生物>微信公众号,获取最新资讯~
