前言
源自驼科动物重链抗体的VHH谱系基因与人类VH3家族显示出高度序列同源性,但VHH域的抗原结合方式和CDR环结构与常规异源二聚体抗体有很大不同。这些差异包括较长的互补决定区H3(CDR-H3)环,框架2(FWR2)区的替代物,非规范二硫键等。它们被认为是VHH能够在没有配对轻链的情况下依然发挥抗原结合作用的原因所在。
尽管过去的研究已经表明VHH中CDR环的结构特性,有助于理解VHH的CDR环构象和抗原相互作用,但我们对VHH中不同CDR-H3环构象的整体异质性、其功能后果以及CDR-H3异质性的起源的理解仍然有限。本期小编为大家带来关于塑造VHH域中独特CDR-H3构象的解读。
CDR-H3环的构象异质性
由于单体性质以及不同的CDR环构象,VHH域的抗原结合主要由CDR-H3环决定。研究表明,VHH抗体中存在结构上的极化。通过使用传统双链抗体的τ101和ɑ101角度,能够将VHH结构分类为伸展(extended)或弯曲(kinked)CDR-H3的两簇。弯曲CDR-H3构象的VHH占比大,其CDR-H3环更长,与FWR2的相互作用更多,是VHH抗体中典型的CDR-H3构象。而伸展的CDR-H3环长度平均较短,与框架的相互作用较少。
表1. 抗体的基因库来源和框架组成在决定VHH抗体中CDR-H3环的构象和稳定性方面起着至关重要的作用。
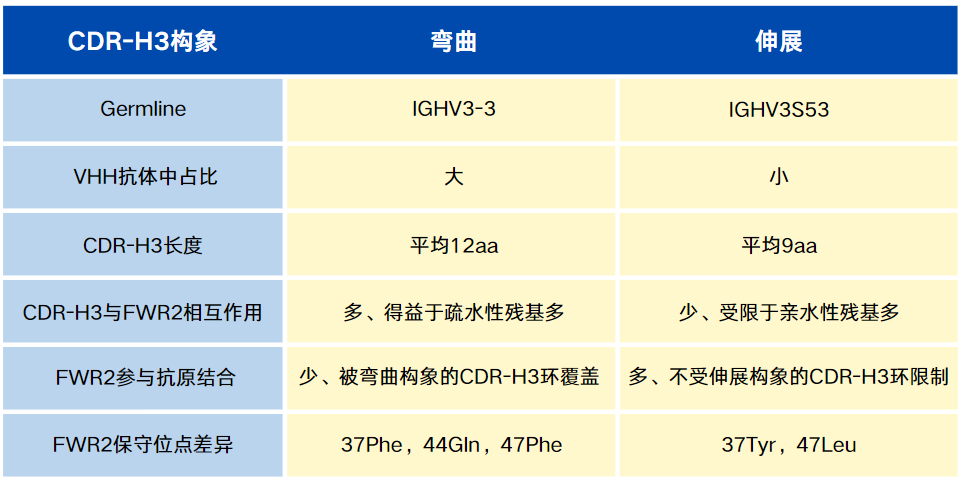
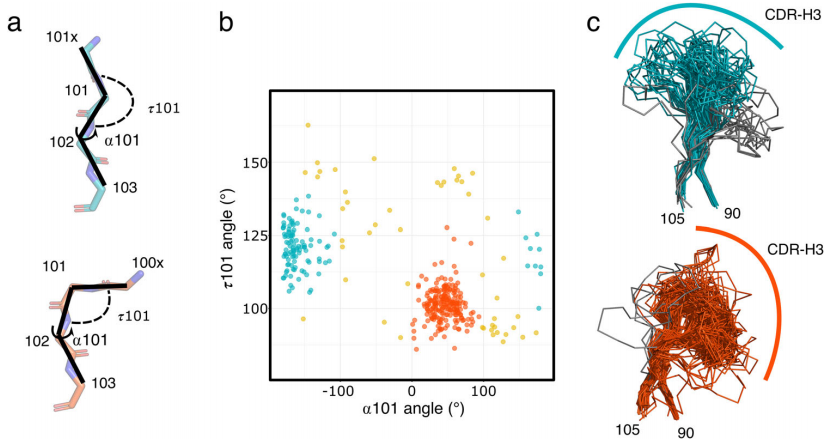
图1. 基于CDR-H3环C端构象对VHH抗体的CDR-H3环进行聚类。
a 伸展(顶部,青色)和弯曲(底部,红色)结构的CDR-H3的C端典型构象。黑色粗线突出显示用于CDR-H3环分类的角度α101和τ101。
b 从lama和alpaca中的一组独特VHH结构(n = 385)中α101和τ101角度的分布。
c CDR-H3区域聚类图,伸展(顶部,青色)和弯曲(底部,红色)。
谱系基因如何影响CDR-H3构象
研究发现,VHH抗体的CDR-H3构象与其来源的基因系谱密切相关。IGHV3-3基因衍生的抗体几乎完全采用弯曲CDR-H3构象,而IGHV3S53基因衍生的抗体则大多采用伸展结构的CDR-H3环。弯曲结构的CDR-H3环比伸展结构更长,前者平均长度位为12个氨基酸,后者为9个氨基酸。
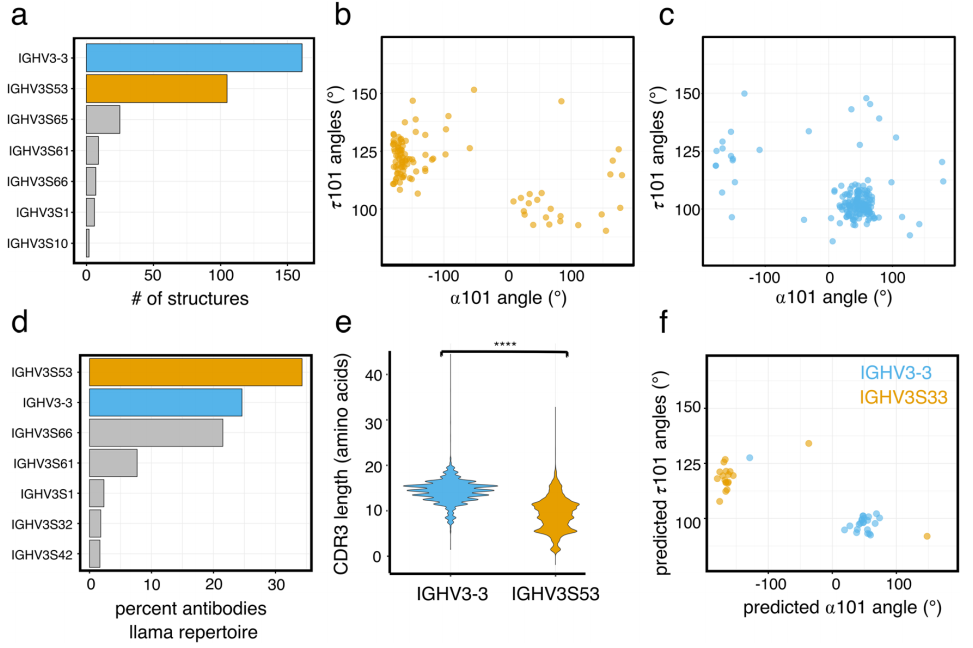
图2. 两类CDR-H3构象在其HV谱系基因使用上存在差异。
a 本研究中使用的VHH结构(n = 385)中最常见的7个VH谱系基因的使用情况。
b 来自IGHV3S53谱系基因的独特VHH结构(n = 106)中的α101和τ101角度分布。
c 来自IGHV3-3谱系基因的独特VHH结构(n = 175)中的α101和τ101角度分布。
d 两个llama免疫库VHH结构最常见的7个VH谱系基因的使用情况。
e 基于IGHV3-3(n = 13462,蓝色)或IGHV3S53(n = 18769,橙色)谱系基因衍生的抗体CDR-H3氨基酸长度分布。
f Alphafold预测的来自IGHV3-3谱系基因的23个VHH序列(蓝色)和来自IGHV3S53谱系基因的19个VHH序列(橙色)的α101和τ101角度。
VH基因与CDR-H3聚类之间的相关性与VDJ重组无关
CDR-H3环是由VH、DH和JH片段的组合编码的。llama免疫库测序数据研究显示,尽管来自不同VH基因的抗体具有不同的CDR-H3构象,但其DH和JH基因的使用频率几乎相同,。而CDR-H3长度差异主要源于JH修剪和DH/NP片段长度的差异。因此,VDJ重组中的偏好并不能解释CDR-H3环长度差异,而可能是B细胞发育过程中选择的结果。
图3. 两只Llama 免疫库中IGHV3-3和IGHV3S53衍生的VHH抗体的VDJ连接性质。
a. IGHV3-3和IGHV3S53基因衍生的抗体IGHD片段使用情况。
b. IGHV3-3和IGHV3S53基因衍生的抗体IGHJ片段使用情况。
c. 抗体的Llama IgG2分布。
d. 直方图显示来自IGHV3-3(上方)和IGHV3S53基因(下方)的抗体中VH片段中最3'、端核苷酸位置的分布。
e. 来自IGHV3-3(n = 10304,蓝色)或IGHV3S53(n = 14451,橙色)VH基因的抗体的NP核苷酸和D片段的核苷酸长度分布。
f. 直方图显示了来自IGHV3-3(上方)和IGHV3S53基因(下方)的抗体中IGHJ4片段中最5'端核苷酸位置的分布。
FWR2如何影响CDR-H3构象
FWR2通过影响FWR2与CDR-H3环之间的相互作用来影响CDR-H3构象。源自IGHV3-3基因的VHH结构具有更长且弯曲的CDR-H3构象,它们与疏水性FWR2之间相互作用更多,如pi-堆积相互作用和骨架相互作用,并且具有较长CDR-H3环的VHH不太容易聚集。相反,源自IGHV3S53基因的VHH结构具有较短CDR-H3环和伸展构象,并且与FWR2的相互作用较少,因为它们的亲水性FWR2不易于提供弯曲CDR-H3构象所需的疏水支架。
弯曲和伸展CDR-H3的VHH结构在FWR2序列差异如下:
1.弯曲结构中FWR2的37和47位通常携带Phe,而伸展CDR-H3结构则在这些位置携带Tyr和Leu。
2.FWR2的44位在具有弯曲CDR-H3环的VHH结构中主要是Gln,而在伸展CDR-H3结构中该位置的保守性较低。
有研究表明,将具有弯曲CDR-H3的VHH移植到具有不同FWR2残基的框架上会导致CDR-H3构象的变化和抗体热稳定性的降低,表明了FWR2对CDR-H3构象的直接影响。

图4. 两种结构性CDR-H3聚类的CDR-H3与FWR中序列和结构差异。
a 伸展CDR-H3结构(n = 100)和b 弯曲CDR-H3构象结构(n = 215)中CDR-H3和FWR2之间的接触图。蓝色热力图表示特定残基对在结构中相互作用的比例。使用Chothia编号方案对FWR2和CDR-H3位置进行编号,除了CDR位置95到100x,这些位置从C端对齐以显示CDR-H3 C端的保守相互作用(详见原文)。c 典型的伸展CDR-H3 VHH结构示意图(PDB code 4LDE.A)。d 典型的弯曲CDR-H3 VHH结构(PDB代码3K7U.A)示意图。e 典型的弯曲CDR-H3 VHH结构(PDB代码1U0Q.A)示意图,CDR-H3中含有一个short 3–10 helix。CDR-H3和FWR中的关键残基如棒状表示。
具有伸展或弯曲CDR-H3环的VHH抗体在抗原结合方面的差异
CDR-H3环的构象影响抗原结合。VHH结构主要利用凸起结合模式,可能是为了弥补缺少轻链的情况。为了维持凸起的结合方式,具有伸展CDR-H3构象的VHH/抗原结构利用了暴露在溶剂中的FWR2进行抗原结合,而具有弯曲CDR-H3环的VHH结构则不太可能这样做。结果是具有伸展CDR-H3环的抗体利用了更大的抗原结合区域。这种VHH的弯曲和伸展CDR-H3环之间的抗原结合差异已被先前指出,并用于设计核糖体展示文库以使抗体结合模式多样化。
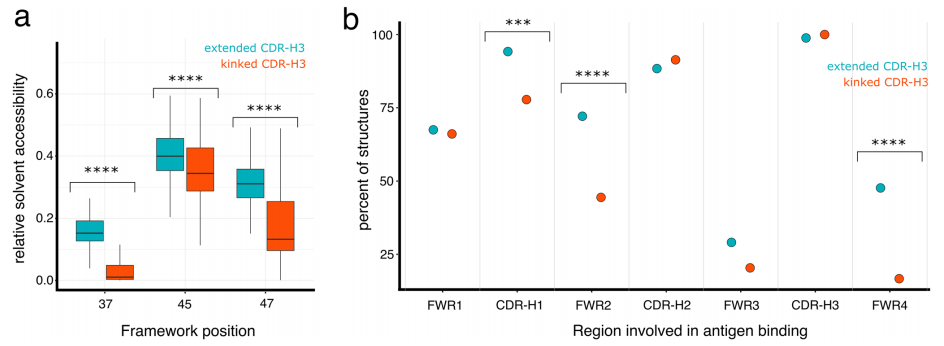
图5. 具有伸展CDR-H3环的VHH抗体的FWR2经常参与抗原结合。
a 伸展(青色,n = 100)或弯曲(红色,n = 215)CDR-H3的VHH结构中FWR2位置37、45和47的相对溶剂可接触面积的箱线图。b 不同VHH抗体结构中不同区域(FWR1-4、CDR-H1-3)与各自抗原发视相互作用的百分比,伸展CDR-H3构象的VHH(青色,n = 86)和弯曲CDR-H3构象的VHH(红色,n = 162)。
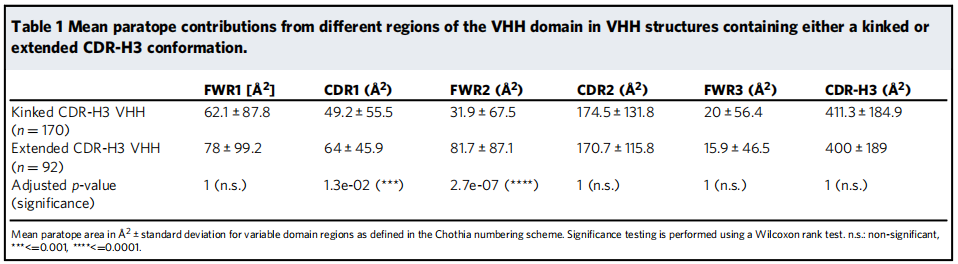
图6. 弯曲或伸展的CDR-H3构象的VHH抗体中不同区域的平均抗原表位贡献。
小结
驼科动物中域抗体的起源尚不清楚,但VHH抗体可能与动物体内常规VH/VL抗体共享其发展过程。驼科动物的VHH抗体表现出VH和JH片段的显著偏向,但除了偏向基因使用外,研究发现CDR-H3环存在结构上的极化,具有截然不同CDR-H3构象簇。这两种构象分别与VH基因的使用方式相关联。在B细胞发育过程中的选择压力与FWR2的生物物理性质共同塑造了VHH独特的CDR-H3环的构象。这些研究工作不仅揭示了VHH抗体的结构多样性,并且也为更好地理解谱系基因如何影响抗原相互作用、免疫库的形成和工程设计提供了重要线索。
参考文献:
Bahrami Dizicheh, Z., Chen, IL. & Koenig, P. VHH CDR-H3 conformation is determined by VH germline usage. Commun Biol 6, 864 (2023). https://doi.org/10.1038/s42003-023-05241-y
了解更多纳米抗体相关内容,可关注<阿帕克生物>微信公众号,获取最新资讯~
