1995年,Andrew等在护士鲨体内发现了不同于IgM和IgW的新型免疫球蛋白IgNAR,其最初被发现与T细胞抗原受体(T Cell Receptor,TCR)同源性较高,从而被命名为新抗原受体NAR,但是后续研究发现该分子与免疫球蛋白存在诸多类似的结构及功能特性,因此被重新命名为IgNAR,IgNAR与传统抗体不同,它是由两条重链组成的同源二聚体,缺乏轻链(图1)。与经典的B细胞受体一样,IgNAR以分泌型和膜结合型的形式存在,由被称为VNAR的可变区和不同数量的恒定区组成。其中,分泌型具有5个恒定区。

图1. 鲨鱼抗体IgNAR结构示意图
IgNAR的起源及进化
软骨鱼纲(Chondrichthyes)是与哺乳动物在进化上距离最远的具有真正适应性免疫系统的脊椎动物,由全头亚纲(Holocephali)和板鳃亚纲(Elasmobranchii)组成。其中板鳃亚纲可分为鲨总目(Selachimorpha)和鳐总目(Batoidea)。据不完全统计目前鲨总目存在超过450个不同的种,鳐总目存在约560个不同的种,由此可知板鳃亚纲鱼类种类远多于骆驼科动物,为VNAR的开发提供了丰富的材料,由于当前针对VNAR的研究集中于鲨总目,为叙述方便,本文所述VNAR特指鲨源单域抗体。
IgNAR的多样性来源
与在其他脊椎动物中发现的转座子(VnDnJnC)基因系统不同,板鳃亚纲鱼类的免疫球蛋白(IgM、IgW和IgNAR)基因以基因簇(VDJC)n形式存在(图2)。每个基因簇由1个V基因片段(Variable gene segment)、多个D基因片段(Diversity gene segment)、1个J基因片段(Joining gene segment)和恒定区外显子组成。IgNAR也由基因簇中的基因编码,其每个基因簇中含有3个D基因片段,因此通常需要4次基因重排,才能产生1个完整的VNAR基因序列。由于IgNAR不含轻链,缺少重链和轻链的组合多样性,同时IgNAR基因簇数量较少,因此IgNAR最主要的多样性来源于长且高度突变的CDR3区。同时,CDR1、HV2和HV4区的突变也能增加IgNAR的多样性。此外对VNAR的结构分析表明,非典型半胱氨酸残基的数量及位置的不同会导致VNAR抗原结合区的构象存在巨大的差异。因此,VNAR中的二硫键不仅可以增加结构的稳定性,还能产生各种各样的构象,从而进一步扩展IgNAR的多样性。
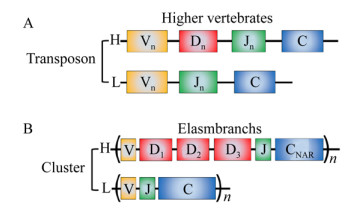
图2. 高等脊椎动物和板鳃亚纲鱼类免疫球蛋白基因的转座子及基因簇排列方式比较
VNAR的类型
根据CDR区和FR区中非典型半胱氨酸残基及保守色氨酸残基的位置和数量可以将VNAR划分为不同的亚型。到目前为止,已经定义了3种主要的VNAR,分别称为类型Ⅰ、Ⅱ和Ⅲ。此外有些VNAR只包含2个高度保守的典型半胱氨酸残基,Liu等和Streltsov等将这些VNAR称为Ⅱb型。同时将在CDR1区含有保守色氨酸残基以及只含有典型半胱氨酸残基的VNAR称为Ⅲb型。所有当前命名的VNAR类型见图3。此外,2019年Feng等通过对约119万条来源于护士鲨的VNAR序列分析发现,护士鲨中存在约5%其他类型的VNAR,其不含或只含有1个半胱氨酸残基。
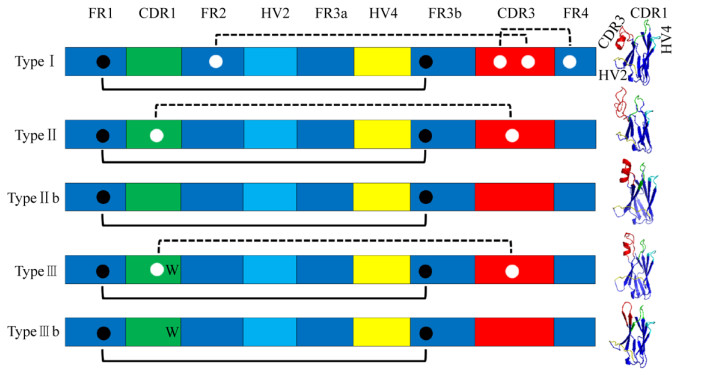
图3. 不同类型的VNAR示意图(左侧为VNAR序列的特征图,其中黑点为典型半胱氨酸残基,白点为非典型氨基酸残基,黑色实线和虚线为二硫键。右侧为不同类型VNAR的三维结构模型。)
迄今为止,Ⅰ型VNAR只在护士鲨中被发现,可能为该物种所特有。该亚型VNAR分别在FR2和FR4区中存在2个非典型半胱氨酸残基,同时在CDR3区中也存在2个以上的半胱氨酸残基。晶体结构分析发现,FR2和FR4中存在的半胱氨酸残基会与CDR3中的2个半胱氨酸残基分别形成二硫键,从而形成1个紧密结构。需要注意的是,Ⅰ型VNAR由于二硫键的束缚导致CDR3区形成的指凸结构的长度较短,难以识别蛋白裂隙深处的抗原表位。
Ⅱ型VNAR与Ⅰ型的不同之处是CDR1区和CDR3区中的2个非典型半胱氨酸会形成二硫键,使上述区域靠近,同时CDR3区可形成1个较长的指凸结构,从而易于与蛋白裂隙等隐藏抗原表位结合。迄今为止,在所有研究的鲨鱼中都发现了Ⅱ型VNAR。
Ⅲ型VNAR与Ⅱ型类似,在CDR1和CDR3区分别存在1个非典型半胱氨酸,此外该亚型在CDR1区半胱氨酸残基附近存在1个保守的色氨酸残基。需要注意的是Ⅲ型VNAR的多样性较低。据推测,Ⅲ型VNAR是保护新生鲨鱼抵御常见病原体的早期广谱抗体,通常只在幼鲨(< 1岁)中表达。除Ⅲ型VNAR外,所有类型的VNAR都能产生高亲和力。
VNAR的主要特性
1. 识别隐藏表位
传统抗体与单域抗体优先识别不同的抗原表位。这主要是因为传统抗体的VH-VL界面通常是平面或者凹面,无法识别蛋白裂隙等隐藏抗原表位,而单域抗体的CDR3区通常较长,可以形成指凸结构,从而能够深入到酶活性中心等蛋白裂隙。
2. 高水溶性和稳定性
IgNAR具有极强的稳定性可在含有350 mmol/L尿素和1 000 mOsm/kg渗透压盐离子的鲨鱼血液中保持生物活性。IgNAR的稳定性可以归因于以下2个因素:1)高水溶性,与传统抗体VH-VL界面相比,VNAR带有大量的带电和亲水氨基酸残基,如Tyr37、Glu46、Lys82、Gln84、Arg101和Lys104,其中Glu46、Lys82和Lys104氨基酸残基的保守性最强,其通过相互之间以及与水分子之间的氢键形成1个带电的内陷结构。此外Tyr37作为免疫球蛋白超家族的保守氨基酸残基与Gln84、Arg101参与形成CDR3区与FR区的氢键网络,最终使得VNAR形成亲水性界面,提高溶解性并保护保守的免疫球蛋白疏水性骨架;2) VNAR的特殊结构,Buchner等发现与哺乳动物抗体相比,VNAR包含1个额外的盐桥和延伸的疏水核。将这些增强稳定性的结构转移到人抗体的可变区之后,可显著提高其稳定性。此外VNAR内部的二硫键也有利于提高其稳定性。
VNAR的应用
VNAR所具备的分子量小、亲和力高、稳定性强、溶解度好、组织穿透性强以及可识别隐藏抗原表位等特性,使得其在应用时具有产品质量稳定、生产成本低、易储存以及货架期长等优点,在药物开发、体外诊断以及免疫检测等领域受到广泛的关注。目前全球有三家公司从事鲨鱼抗体药物研发:Ossianix,Elasmogen,AdAlta,只有AdAlta的AD-214进入临床研究阶段。

总部位于澳大利亚墨尔本的AdAlta是一家创新的临床阶段生物技术公司,基于i-body技术开发靶向纤维化,炎症和癌症有关的G蛋白耦联受体家族 (GPCRs)抗体药物。AdAlta开创的i-body专利合成文库技术是将鲨鱼抗体CDR1与CDR3嫁接到人类神经细胞粘附因子上,同时在分子内部引入一对二硫键稳定蛋白结构,该噬菌体合成文库超过200亿种i-body。 AD-214是AdAlta开发的一种与CXR4特异结合的i-body,同时与人Fc融合,用于治疗特发性肺纤维化, AD-214已通过静脉给药成功完成 I 期安全性研究。同时AdAlta在开发AD-214可吸入制剂,以提高生物利用率、改善患者便利性并降低成本。
参考资料:
1. 刘星, 陈奇. 鲨源单域抗体的研究进展. 生物工程学报, 2020, 36(6): 1069-1082
2. Juma, S.N.; Gong, X.; Hu, S.; Lv, Z.; Shao, J.; Liu, L.; Chen, G. Shark New Antigen Receptor (IgNAR): Structure, Characteristics and Potential Biomedical Applications. Cells 2021, 10, 1140. https://doi.org/10.3390/ cells10051140
了解更多纳米抗体相关内容,可关注<阿帕克生物>微信公众号,获取最新资讯~
