纳米抗体(Nanobody or VHH)由3个高变区域的抗原互补决定区 (complementarity determiningregions,CDRs)和4个框架区域 (frameworkregions,FRs)组成, 其序列和空间结构与传统抗体在以下方面的特征。
增加亲水性氨基酸与较长的CDR1和CDR3
传统抗体VH和VL通过疏水作用力来稳定结构并共同构成抗原结合区。与之相比,VHH仅含有3个可变区,尽管与抗原结合界面的表面积减少,但其仍具有较高的稳定性与亲和力。它主要通过以下方式来适应轻链的缺失:
a. 大量的亲水性氨基酸(图b中黄色圆点)取代先前与CH1、VL结合界面的脂肪族残基(L12S、V42F/Y、G49E、L50R/C、W52G/L),且部分FR2被拉伸扭转的CDR3环覆盖,避免与外界水环境的接触,从而防止Nbs的二聚化,其CDR3环越长,Nbs越稳定。另外还可在CDR3末端形成疏水核心,有利于稳定Nbs的折叠结构域。
b. VHH的CDR1和CDR3普遍比VH的长,潜在地增加了互补位构象的多样性,从而以高度的形状表面互补性与相应的抗原结合,一定程度上弥补了轻链缺失造成的抗原结合力下降以及因尺寸小而导致的潜在序列多样性降低。增长的CDR1区域起源于种系基因,突变热点的存在导致VHH向N 端延长。而较长的 CDR3区域可能是由于 V-D-J重组后功能性 VHH 域的选择。
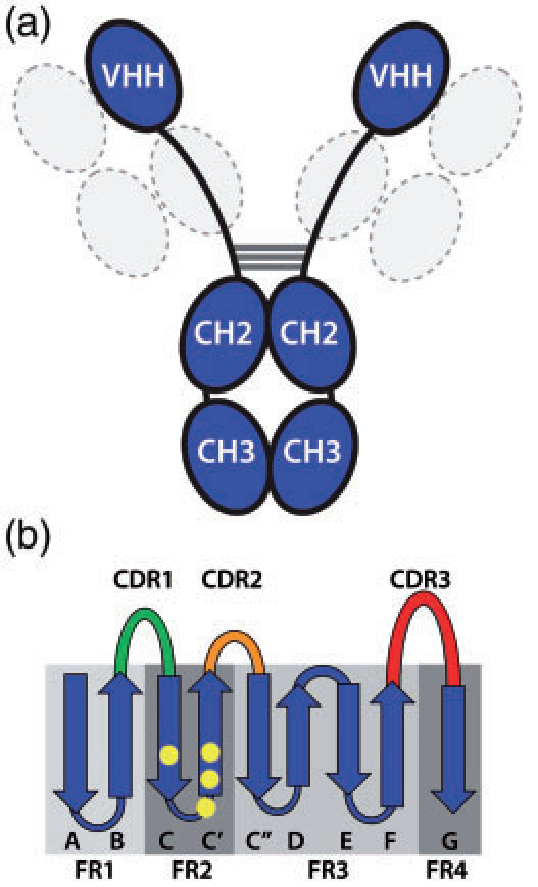
图1. 重链抗体(a)与其可变结构域(b)示意图
二硫键与 Nb稳定性的关系
通过对比常规抗体与VHH的结构可知,大部分VHH 序列是通过二硫键来约束长序列环从而解决由于CDR3区扩展可能引起的稳定性问题。VHH中的二硫键类型分为保守和额外二硫键。几乎所有的 VHH 序列有一个连接FR1(C23)和FR3(C104)的保守二硫键,该键跨越蛋白质的内部,将两个β链连接起来,增加了结构稳定性。部分VHHs还含有一个可限制CDR环柔韧性和构象自由度的额外二硫键,且其位置与数量各不相同。研究表明,许多骆驼的VHH 序列在 CDR1区和 CDR3区中均包含一对额外的半胱氨酸(Cysteine,Cys)残基,它们会形成环间二硫键。单峰骆驼的VHH 序列中的环间二硫键主要在 CDR1区和 CDR3区之间形成,而部分单峰骆驼的 VHH 序列则在CDR3区和CDR2区之间形成环间二硫键。
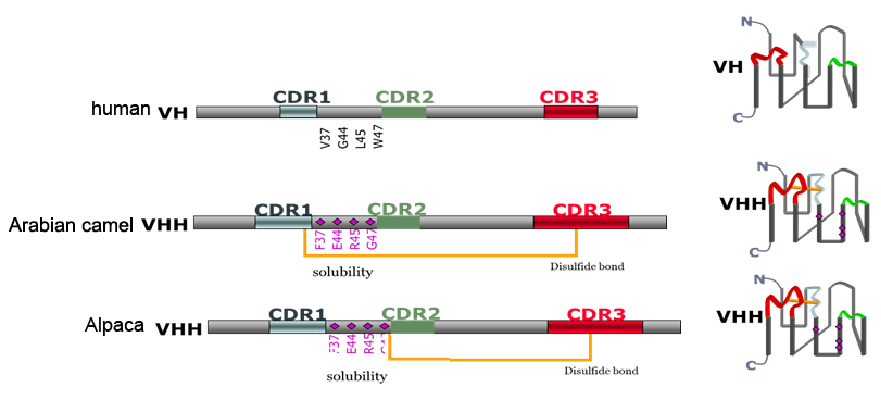
互补位构象与抗原结合活性
研究表明,VHH CDRs的结构多样性高于传统VH域。研究表明VHH的CDR1、CDR2、CDR3区所形成的的环高度可变,这些环在折叠蛋白结构域的一侧形成扩展的结构界面,有利于形成抗原结合界面,非常适合插入对应抗原分子的沟槽或裂隙内,增大与抗原的相互作用面积,从而产生了多种抗原结合特异性。 常规抗体的抗原结合片段呈凹陷或平面状,只能识别抗原表面,而VHH包含1个主要由CDR3环组成的呈扁长形状且暴露凸起的互补位,可以优先识别裂口,并结合这些隐藏和凹陷的抗原表位,而常规抗体是难以识别这些表位。
近年来关于 VHH的相关研究为从微观层面认识 Nb的优良结构基础提供了理论依据。通过对VHH进行结构表征,可指导 VHH定向改造,有望在生物医药领域及基因工程方面进行更深层次的应用。
参考文献:
1. Ciccarese S,et al. The Camel Adaptive Immune Receptors Repertoire as a Singular Example of Structural and Functional Genomics. Frontiers in Genetics. 2019.00997
2. Robert J Hoey, H, et al. Structure and development of single domain antibodies as modules for therapeutics and diagnostics. Experimental Biology and Medicine 2019; 244: 1568–1576
了解更多纳米抗体相关内容,可关注<阿帕克生物>微信公众号,获取最新资讯~
